题目内容
1.将两份相同质量的铝,分别投入足量的稀硫酸和氢氧化钠溶液中,充分反应后产生氢气的质量( )| A. | 与硫酸产生氢气多 | B. | 与氢氧化钠溶液产生氢气多 | ||
| C. | 两者产生氢气一样多 | D. | 无法判断 |
分析 根据铝与足量的稀硫酸和氢氧化钠溶液反应的化学方程式可知,酸、碱足量时,铝完全反应,则铝的质量相等生成的氢气也相等,由此分析解答.
解答 解:由2Al+3H2SO4=Al2(SO4)3+3H2↑、2Al+2H2O+2NaOH=2NaAlO2+3H2↑可知,酸、碱均过量,则铝完全反应,铝的质量相等,从方程式中可以看到铝与氢气的比例都是2:3,因此产生的氢气是一样多,
故选C.
点评 本题主要考查了铝与酸、碱的反应,明确铝与氢氧化钠的反应方程式及Al的质量相同是解题关键,题目难度中等.

练习册系列答案
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案
相关题目
9.下列叙述不正确的是( )
| A. | 异戊二烯分子里的所有原子不可能在同一平面上 | |
| B. | 浓氨水洗涤做过银镜反应的试管 | |
| C. | 油脂皂化反应得到高级脂肪酸盐与甘油 | |
| D. | 聚合物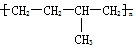 可由单体CH3CH=CH2和CH2=CH2加聚制得 可由单体CH3CH=CH2和CH2=CH2加聚制得 |
16.需要加入氧化剂才能实现的变化是( )
| A. | MnO2→MnSO4 | B. | KI→KIO3 | C. | HNO 3→NO | D. | Al2O 3→Al(OH)3 |
6.下列叙述正确的是( )
| A. | 1 mol H2SO4的质量是98 g/mol | |
| B. | CO2的摩尔质量等于CO2的相对分子质量 | |
| C. | 摩尔质量建立了物质的物质的量与物质的质量之间的联系 | |
| D. | 1 mol任何物质的质量等于该物质的相对分子质量 |
13. 25℃时,三种酸的电离平衡常数如表:
25℃时,三种酸的电离平衡常数如表:
(1)常温下,若三者体积均为200mL 浓度均为0.1mol•L-1,则三者中C(H+)最小的是次氯酸(填名称).
(2)相同条件下,体积均为200mL、浓度均为0.1mol•L-1的CH3COOH(aq)和HCl(aq)分别与100mL 0.2mol•L-1NaOH溶液反应,放出热量较少的是醋酸 (填名称).
(3)下列四种离子结合质子能力由大到小的顺序是a>b>d>c(填序号).
a.CO32-b.ClO- c.CH3COO-d.HCO3-
(4)向次氯酸钠溶液中通入少量二氧化碳,写出该过程中反应的离子方程式:ClO-+CO2+H2O=HCO3-+HClO.
(5)在一定温度下,有 a.盐酸 b.硫酸 c.醋酸三种酸,当三者c(H+)相同且体积相同时,同时加入形状、密度、质量完全相同的锌粒,若产生相同体积的H2(相同状况),则开始时反应速率的大小关系为a=b=c(填序号),反应所需时间的长短关系是a=b>c(填序号).
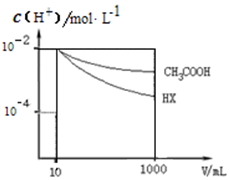
(6)相同条件下,体积均为10mL、c(H+)为0.01mol•L-1的醋酸溶液与HX溶液分别加水稀释至1000mL,稀释过程中c(H+)变化如图所示.
则HX的电离平衡常大于(填“大于”、“等于”或“小于”)醋酸的电离平衡常数.
 25℃时,三种酸的电离平衡常数如表:
25℃时,三种酸的电离平衡常数如表:| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10-5 | K1 4.3×10-7 K2 5.6×10-11 | 3.0×10-8 |
(2)相同条件下,体积均为200mL、浓度均为0.1mol•L-1的CH3COOH(aq)和HCl(aq)分别与100mL 0.2mol•L-1NaOH溶液反应,放出热量较少的是醋酸 (填名称).
(3)下列四种离子结合质子能力由大到小的顺序是a>b>d>c(填序号).
a.CO32-b.ClO- c.CH3COO-d.HCO3-
(4)向次氯酸钠溶液中通入少量二氧化碳,写出该过程中反应的离子方程式:ClO-+CO2+H2O=HCO3-+HClO.
(5)在一定温度下,有 a.盐酸 b.硫酸 c.醋酸三种酸,当三者c(H+)相同且体积相同时,同时加入形状、密度、质量完全相同的锌粒,若产生相同体积的H2(相同状况),则开始时反应速率的大小关系为a=b=c(填序号),反应所需时间的长短关系是a=b>c(填序号).
(6)相同条件下,体积均为10mL、c(H+)为0.01mol•L-1的醋酸溶液与HX溶液分别加水稀释至1000mL,稀释过程中c(H+)变化如图所示.
则HX的电离平衡常大于(填“大于”、“等于”或“小于”)醋酸的电离平衡常数.
10.根据生活经验,判断下列物质按酸碱性的一定顺序依次排列正确的是( )
| A. | 厕所清洁剂 厨房清洁剂 醋 肥皂 | |
| B. | 醋 厕所清洁剂 厨房清洁剂 肥皂 | |
| C. | 厕所清洁剂 醋 肥皂 厨房清洁剂 | |
| D. | 厨房清洁剂 厕所清洁剂 肥皂 醋 |
 Na2S2O3是重要的化工原料,易溶于水.在中性或碱性环境中稳定.
Na2S2O3是重要的化工原料,易溶于水.在中性或碱性环境中稳定.