题目内容
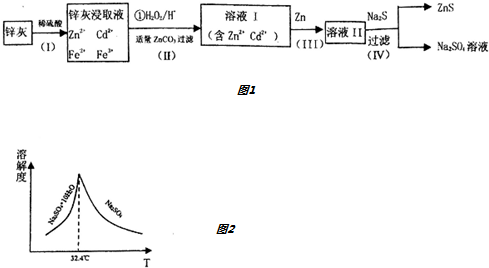
5.氮化镁(Mg3N2)是一种黄绿色粉末,可用于制造特殊陶瓷材料、催化剂等,可由金属镁和纯净的氮气反应制得,某化学兴趣小组同学利用如图所示装置来制备少量的Mg3N2.
已知Mg3N2易与水反应,有关反应方程式为Mg3N2+6H2O═3Mg(OH)2↓+2NH3↑.
回答下列问题:
(1)装置A中反应容器的名称为锥形瓶.
(2)装置B中的试剂为碱石灰,装置F的作用是防止空气中水蒸气进入硬质玻璃管E中.
(3)装置C、E均需要加热,应先加热C,理由是使C中产生的氮气排出E中的空气.
(4)装置C中的现象是黑色的氧化铜逐渐变红,有关反应的化学方程式为2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2↑+3H2O.
(5)若C中NH3的转化率不高,易产生的问题是D中发生倒吸现象,解决方法是在C、D之间加上一个缓冲瓶.
(6)若实验结束后,将装置E中固体全部取出,称量为ag,向其中依次加入足量的稀盐酸和NaOH溶液,充分反应后过滤、洗涤、干燥,最后得沉淀bg,则产品中氮化镁的质量分数为$\frac{a-\frac{12}{29}b}{0.28a}$.
分析 (1)由装置A中反应容器为锥形瓶;
(2)(3)A装置制备氨气,B中碱石灰干燥氨气,C中氨气与CuO反应生成制备氮气,D中浓硫酸干燥氮气,E装置中氮气与Mg反应生成氮化镁,加热条件下装置中氧气与Mg反应生成MgO,应下用氮气排尽装置内空气后再制备氮化镁,F防止空气中水蒸气进入硬质玻璃管E,避免氮化镁发生水解;
(4)装置C中的现象是黑色的氧化铜逐渐变红,说明生成Cu,氨气被氧化生成氮气,还还生成水;
(5)D中浓硫酸会吸收氨气,可能发生倒吸;
(6)最终达到沉淀bg为氢氧化镁的质量,根据Mg元素守恒计算产品中Mg元素质量,再计算N元素质量,根据N原子守恒计算氮化镁的质量,进而计算产品中氮化镁的质量分数.
解答 解:(1)由装置A中反应容器为锥形瓶,故答案为:锥形瓶;
(2)A装置制备氨气,B中碱石灰干燥氨气,C中氨气与CuO反应生成制备氮气,D中浓硫酸干燥氮气,E装置中氮气与Mg反应生成氮化镁,加热条件下装置中氧气与Mg反应生成MgO,应下用氮气排尽装置内空气后再制备氮化镁,F防止空气中水蒸气进入硬质玻璃管E,避免氮化镁发生水解,
故答案为:碱石灰;防止空气中水蒸气进入硬质玻璃管E中;
(3)装置C、E均需要加热,应先加热C后加热E,理由是:使C中产生的氮气排出E中的空气,防止生成氧化镁,
故答案为:C;使C中产生的氮气排出E中的空气;
(4)装置C中的现象是黑色的氧化铜逐渐变红,说明生成Cu,氨气被氧化生成氮气,还还生成水,反应方程式为:2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2↑+3H2O,
故答案为:2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2↑+3H2O;
(5)若C中NH3的转化率不高,D中浓硫酸会吸收氨气,容易发生倒吸,解决方法是:在C、D之间加上一个缓冲瓶,
故答案为:D中发生倒吸现象;在C、D之间加上一个缓冲瓶.
(6)最终达到沉淀bg为氢氧化镁的质量,根据Mg元素守恒,产品中Mg元素质量为bg×$\frac{24}{58}$,则产品中N元素质量为(a-$\frac{24}{58}$b)g,根据N原子守恒,氮化镁的质量分数为[$\frac{(a-\frac{24}{58}b)g}{14g/mol}$×$\frac{1}{2}$×100g/mol]÷ag=$\frac{a-\frac{12}{29}b}{0.28a}$,
故答案为:$\frac{a-\frac{12}{29}b}{0.28a}$.
点评 本题考查物质制备实验、物质含量测定等,关键是对制备原理与各装置的理解,注意制备中避免水解及杂质生成,题目综合考查学生对知识的迁移运用、分析能力、实验能力等,掌握元素化合物性质与实验制备原则.

| A. | 不能发生氧化反应 | |
| B. | 至少有三种同分异构体可以水解得到甲酸或甲醇 | |
| C. | 至少有三种同分异构体能与NaOH溶液反应 | |
| D. | 分子中含有碳碳双键或碳氧双键 |
| A. | 离子半径:Y>Z>W>R>X | |
| B. | 氢化物稳定性:X>W>R | |
| C. | Y、Z、W的最高价氧化物对应的水化物两两均可互相反应 | |
| D. | Y与Z不能存在于同一离子化合物中 |
| A. | 开发新能源,减少对化石能源的依赖 | |
| B. | 将燃煤进行脱硫处理,可减少酸雨的形成 | |
| C. | 雾霾(颗粒直径为2.5 x103 nm)具有丁达尔效应 | |
| D. | 推广使用电动汽车,可减少城市雾霾的形成 |
| A. | 负极反应式为CH4+10OH--8e-═CO32-+7H2O | |
| B. | 正极反应式为O2+2H2O+4e-═4OH- | |
| C. | 随着不断放电,电解质溶液碱性不变 | |
| D. | 甲烷燃料电池也可以用稀硫酸做电解质溶液 |

 HN03和 HN02是氮的两种重要含氧酸.HN02能被常见的氧化剂(如高锰酸钾、重铬酸钾等)氧化;在酸性条件下也能被亚铁离子、碘离子还原;亚硝酸银( AgN02 )是一种难溶于水、易溶于酸的化合物.回答下列问题:
HN03和 HN02是氮的两种重要含氧酸.HN02能被常见的氧化剂(如高锰酸钾、重铬酸钾等)氧化;在酸性条件下也能被亚铁离子、碘离子还原;亚硝酸银( AgN02 )是一种难溶于水、易溶于酸的化合物.回答下列问题: 的分子式为:C4H8O.
的分子式为:C4H8O.