题目内容
16.硫化锌(ZnS)是一种重要的化工原料,难溶于水,可由炼锌的废渣锌灰制取t其工艺流程如图1所示.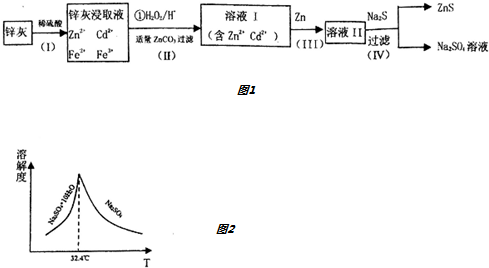
(1)为提高锌灰的浸取率,可采用的方法是①②③⑤(填序号).
①研磨 ②多次浸取 ③升高温度 ④加压 ⑤搅拌
(2)步骤Ⅱ中加入ZnCO3的作用是ZnCO3+2H+=Zn2++CO2↑+H2O、Fe3++3H2O=Fe(OH)3↓+3H+(用离子方程式表示),所得滤渣中的物质是Fe(OH)3、ZnCO3(写化学式).
(3)步骤Ⅳ还可以回收Na2SO4来制取Na2S及Na2SO4•10H2O.
①等物质的量的Na2SO4和CH4在高温、催化剂条件下可以制取Na2S,化学反应方程式为Na2S04+CH4$\frac{\underline{\;\;\;高温\;\;\;}}{催化剂}$Na2S+2H2O+CO2;
②Na2S可由等物质的量的Na2S04和CH4在高温、催化剂条件下制取.化学反应方程式为Na2S04+CH4$\frac{\underline{\;\;\;高温\;\;\;}}{催化剂}$Na2S+2H2O+CO2;
③已知Na2SO4•10H2O及Na2SO4的溶解度随温度变化曲线如图2.从滤液中得到Na2SO4•10H2O晶体的操作方法是蒸发浓缩,降温结晶,过滤
(4)若步骤Ⅱ加入的ZnCO3为b mol,步骤Ⅲ所得Cd为d mol,最后得到VL、物质的量浓度为
c mol/L的Na2SO4溶液.则理论上所用锌灰中含有锌元素的质量为65(Vc-b-d)g.
分析 锌灰与硫酸反应得含有镉离子、锌离子、铁离子、亚铁离子等的溶液,加入双氧水将二价铁离子氧化为三价铁离子,用碳酸锌调节平衡pH使Fe(OH)3完全沉淀,过滤后得到含有镉离子、锌离子的滤液Ⅰ和滤渣Fe(OH)3、ZnCO3;步骤Ⅲ中加入锌,过滤后得溶液Ⅱ为硫酸锌溶液,硫酸锌溶液中加入硫化钠可得硫酸钠和硫化锌,
(1)根据有效化学反应速率的因素分析,如搅拌、适当升温、将废渣碾细成粉末、搅拌、多次浸取等都可提高锌灰的浸取率;
(2)用碳酸锌调节平衡pH使Fe(OH)3完全沉淀,根据上面的分析判断步骤Ⅱ所得滤渣的组成;
(3)①②等物质的量的Na2S04和CH4在高温、催化剂条件下生成Na2S,根据元素守恒写出该化学反应方程式;
③根据溶解度随温度变化曲线分析从滤液中得到Na2SO4.10H2O的操作方法;
(4)步骤Ⅲ所得Cd为d mol,则用于置换镉的锌的物质的量为d mol,硫酸钠的物质的量为:VL×c mol/L=cVmol,所以硫酸锌的物质的量为cVmol,根据锌元素守恒可知,样品中锌元素的物质的量,然后根据m=nM计算出锌灰中含有锌元素的质量.
解答 解:锌灰与硫酸反应得含有镉离子、锌离子、铁离子、亚铁离子等的溶液,加入双氧水将二价铁离子氧化为三价铁离子,用碳酸锌调节平衡pH使Fe(OH)3完全沉淀,过滤后得到含有镉离子、锌离子的滤液Ⅰ和滤渣Fe(OH)3、ZnCO3;步骤Ⅲ中可得Cd单质,为避免引入新的杂质,试剂b应为锌,过滤后得溶液Ⅱ为硫酸锌溶液,硫酸锌溶液中加入硫化钠可得硫酸钠和硫化锌,
(1)搅拌、适当升温、将废渣碾细成粉末、搅拌、多次浸取等都可提高锌灰的浸取率,故选①②③⑤;
(2)根据上面的分析可知,用碳酸锌调节平衡pH使Fe(OH)3完全沉淀,反应的离子方程式为ZnCO3+2H+=Zn2++CO2↑+H2O、Fe3++3H2O=Fe(OH)3↓+3H+,所以步骤Ⅱ所得滤渣为Fe(OH)3、ZnCO3,
故答案为:ZnCO3+2H+=Zn2++CO2↑+H2O、Fe3++3H2O=Fe(OH)3↓+3H+;Fe(OH)3、ZnCO3;
(3)①②等物质的量的Na2S04和CH4在高温、催化剂条件下生成Na2S,根据元素守恒可知,该化学反应方程式为:Na2S04+CH4$\frac{\underline{\;\;\;高温\;\;\;}}{催化剂}$Na2S+2H2O+CO2,
故答案为:Na2S04+CH4$\frac{\underline{\;\;\;高温\;\;\;}}{催化剂}$Na2S+2H2O+CO2;
③根据溶解度随温度变化曲线可知,从滤液中得到Na2SO4.10H2O的操作方法是蒸发浓缩,降温结晶,过滤,
故答案为:蒸发浓缩,降温结晶,过滤;
(4)步骤Ⅲ所得Cd为d mol,则用于置换镉的锌的物质的量为d mol,硫酸钠的物质的量为:VL×c mol/L=cVmol,所以硫酸锌的物质的量为cVmol,
根据锌元素守恒可知,样品中锌元素的物质的量为:cVmol-d mol-b mol,
所以锌灰中含有锌元素的质量为:65g/mol×(cVmol-d mol-b mol)=65(Vc-b-d)g,
故答案为:65(Vc-b-d)g.
点评 本题为工艺流程题,通过从废渣中制取硫化锌的工艺流程,考查了溶解平衡的移动、氧化还原方程式的书写、物质的分离等知识,熟悉物质的性质、明确流程是解题关键,试题侧重学生分析问题、解决问题能力的培养,题目难度中等.

 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | E | R | F | |||||
| 3 | A | C | D | H | I | G | ||
| 4 | B |
(2)在所示十种元素中,原子半径最小的是O,原子半径最大的是K.(均填元素符号)
(3)C元素在周期表中的位置:第三周期IIA族.
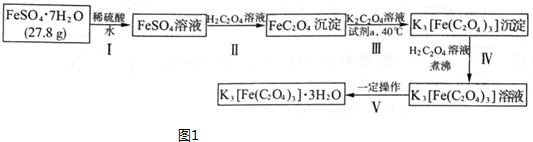
(4)写出EF2分子的电子式
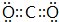 .
.(5)H、I、G三种元素的氧化物对应的水化物中酸性由大到小的顺序排列为HClO4>H2SO4>H2SiO3.(填化学式).
(6)写出G的单质与A的最高价氧化物对应水化物反应的离子方程式Cl2+2OH-=Cl-+ClO-+H2O.
(7)E单质和R的最高价氧化物对应水化物相互反应的化学方程式C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ 4NO2↑+CO2↑+2 H2O.
①将碱式滴定管用蒸馏水洗净,待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入20.00mL待测溶液到锥形瓶中.
②将酸式滴定管用蒸馏水洗净,再用标准酸液润洗2-3次后,向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数.
③向锥形瓶中滴入酚酞作指示剂,进行滴定.滴定至指示剂刚好变色,且半分钟内颜色不再改变为止,测得所耗盐酸的体积为V1mL.
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2 mL.试回答下列问题:
(1)锥形瓶中的溶液从红色色变为无色 色时,停止滴定.
(2)该小组在步骤①中的错误是将锥形瓶用蒸馏水洗净后,又用待测溶液润洗锥形瓶2~3次,由此造成的测定结果偏高(偏高、偏低或无影响).
根据下列数据:请计算待测烧碱溶液的浓度为:
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 20.00 | 0.50 | 22.60 |
| 第二次 | 20.00 | 1.00 | 24.50 |
| 第三次 | 20.00 | 2.10 | 24.00 |
| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
(1)该反应的平衡常数表达式K=$\frac{c(C{O}_{2})}{c(CO)}$,由于随着温度升高,平衡常数减小,所以正反应是放热反应(填“吸”或“放”);
(2)欲提高反应中CO的平衡转化率,可采取的措施是C;
A.减少Fe的量 B.增加Fe2O3的量 C.移出部分CO2
D.加入合适的催化剂 E.增大容器的容积
(3)在一个容积为1L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各2.0mol,反应经过5min后达到平衡.求该时间范围内反应的平均反应速率:v (CO2)=0.24mol•(L•min)-1、CO的平衡转化率=60%.
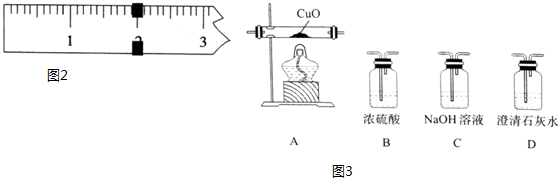
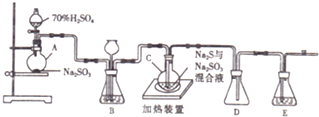

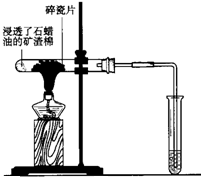 如图所示,将浸透了石蜡油的(17个碳原子以上的液态烷烃混合物)的石棉放置在硬质试管的底部,试管中加入碎瓷片,给碎瓷片加强热,石蜡油蒸汽通过炽热的碎瓷片表面发生反应,生成一定量的气体.利用该气体进行实验:
如图所示,将浸透了石蜡油的(17个碳原子以上的液态烷烃混合物)的石棉放置在硬质试管的底部,试管中加入碎瓷片,给碎瓷片加强热,石蜡油蒸汽通过炽热的碎瓷片表面发生反应,生成一定量的气体.利用该气体进行实验: