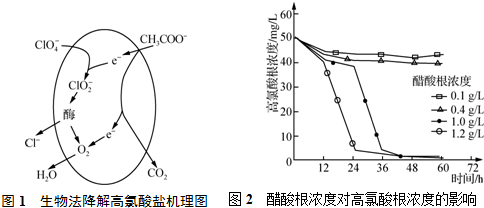
题目内容
5.K值大小与温度的关系是:温度升高,K值可能增大也可能减小(填“一定增大”、“一定减小”、或“可能增大也可能减小”).分析 若正反应为吸热反应,升高温度平衡正向移动,平衡常数增大,若正反应为放热反应,升高温度平衡逆向移动,平衡常数减小.
解答 解:若正反应为吸热反应,升高温度平衡正向移动,平衡常数增大,若正反应为放热反应,升高温度平衡逆向移动,平衡常数减小,由于正反应反应是放热反应还是吸热反应未知,故平衡常数可能增大也可能减小,
故答案为:可能增大也可能减小.
点评 本题考查化学平衡影响因素、平衡常数影响因素,为高频考点,比较基础,注意平衡常数只受温度影响.

练习册系列答案
 导学教程高中新课标系列答案
导学教程高中新课标系列答案
相关题目
15.在PH=1的溶液中,下列各组离子能大量共存的是( )
| A. | Al3+、Fe2+、Ba2+、NO3- | B. | Na+、K+、HCO3-、Cl- | ||
| C. | Ag+、Na+、NO3-、Cl- | D. | NH4+、Fe3+、SO42-、Cl- |
16.下列反应的离子方程式书写正确的是( )
| A. | NH4HCO3溶于过量的浓KOH溶液中并加热:NH4++HCO3-+2OH-=CO32-+NH3↑+2H2O | |
| B. | 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH -=2 Al(OH)3↓+3BaSO4↓ | |
| C. | 向FeI2溶液中通入少量氯气:2Fe2++Cl2=2Fe3++2Cl- | |
| D. | 磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+3H2O |
13.只能用排空气法收集的气体是( )
| A. | NO | B. | N2 | C. | Cl2 | D. | NH3 |
20.已知几种物质的酸性强弱顺序为HCl>H2CO3> >HCO3-,则下列化学方程式错误的是( )
>HCO3-,则下列化学方程式错误的是( )
 >HCO3-,则下列化学方程式错误的是( )
>HCO3-,则下列化学方程式错误的是( )| A. |  +HCl→ +HCl→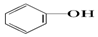 +NaCl +NaCl | B. |  +H2O+CO2→ +H2O+CO2→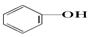 +NaHCO3 +NaHCO3 | ||
| C. | 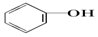 +Na2CO3→ +Na2CO3→ +NaHCO3 +NaHCO3 | D. |  +NaHCO3→ +NaHCO3→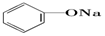 +H2CO3 +H2CO3 |
14.化学与生活密切相关,下列说法不正确的是( )
| A. | 水陆两用公共汽车中,用于密封的橡胶材料是高分子化合物 | |
| B. | 下雪后,常用播撒NaCl颗粒方法来防止道路结冰 | |
| C. | 用活性炭为糖浆脱色和用SO2漂白纸浆的原理不同 | |
| D. | 在医学上用BaSO4做钡餐,是因为Ba2+对人体无毒 |