题目内容
4.下列有关说法错误的是( )| A. | 氯化钠溶液和醋酸铵溶液均显中性,两溶液中水的电离程度也相同 | |
| B. | 84消毒液(含NaClO)产生消毒作用的离子反应为CO2+H2O+ClO-=HClO+HCO3- | |
| C. | 在硫化钠稀溶液中,c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| D. | 25℃时,将0.1mol•L-1氢氧化钠溶液与0.06mol•L-1硫酸溶液等体积混合,该混合溶液的pH等于2.0 |
分析 A.酸或碱抑制水电离,含有弱根离子的盐促进水电离;
B.二氧化碳与NaClO反应生成HClO和碳酸钠;
C.结合质子守恒分析;
D.设体积均为1L,n(NaOH)=0.1mol,n(H+)=1L×0.06mol/L×2=0.12mol,酸过量,以此计算pH.
解答 解:A.氯化钠是强酸强碱盐,对水的电离无影响,醋酸铵是弱酸弱碱盐,促进水电离,故A错误;
B.84消毒液(含NaClO)产生消毒作用的离子反应为CO2+H2O+2ClO-=2HClO+CO32-,故B错误;
C.由质子守恒可知,在硫化钠稀溶液中,c(OH-)=c(H+)+c(HS-)+2c(H2S),故C错误;
D.设体积均为1L,n(NaOH)=0.1mol,n(H+)=1L×0.06mol/L×2=0.12mol,酸过量,c(H+)=$\frac{0.12mol-0.1mol}{2L}$=0.01mol/L,pH=-lg(0.01)=2,该混合溶液的pH等于2.0,故D正确;
故选D.
点评 本题考查离子浓度比较、盐类水解及pH的计算等,为高频考点,把握水解原理的应用、溶液中离子浓度的关系及pH计算为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度不大.

练习册系列答案
相关题目
14.某小组为研究电化学原理,设计如图装置.下列叙述不正确的是( )


| A. | a和b不连接时,铁片上会有金属铜析出 | |
| B. | a和b用导线连接时,铜片上发生的反应为:Cu2++2e-═Cu | |
| C. | a和b用导线连接时,电子由铜电极流向铁电极 | |
| D. | 无论a和b是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色 |
15.14C常用于测定生物遗骸的年份.下列说法中正确的是( )
| A. | 14C的质量数为14g•mol-1 | B. | 14C与12C是两种不同的核素 | ||
| C. | 14C与C60互为同素异形体 | D. | 14C与14N的中子数相同 |
12.现有①、②、③三种元素的基态原子的电子排布式如下:①1s22s22p63s2; ②1s22s22p63s23p1;③1s22s22p3;④1s22s22p4.则下列有关比较中不正确的是( )
| A. | 电负性:④>③>②>① | B. | 最高正化合价:③>①>②>④ | ||
| C. | 原子半径:①>②>③>④ | D. | 第一电离能:④>③>②>① |
19.下列叙述中正确的是( )
| A. | 离子化合物中可能含共价键 | |
| B. | 共价化合物中可能含离子键 | |
| C. | 两种元素构成的共价化合物分子中的化学键都是极性键 | |
| D. | 含有非极性键的化合物一定是共价化合物 |
16.医学研究证明,用放射性${\;}_{53}^{135}$Ⅰ治疗肿瘤可收到一定疗效,下列有关${\;}_{53}^{135}$Ⅰ的叙述正确的是( )
| A. | 核内的中子数为53 | |
| B. | 核内的电子数为135 | |
| C. | 核内的中子数与核外电子数之差为29 | |
| D. | 质量数为82 |
13.X、Y、Z、W均为短周期元素,原子序数依次递增.X与W位于同一主族,Y、Z、W同周期,Z原子的最外层电子数是最内层电子数的3倍,Y、Z、W原子的最外层电子数之和为15.下列说法正确的是( )
| A. | X的最高价氧化物对应水化物的酸性大于W | |
| B. | Z的气态氢化物的稳定性大于W | |
| C. | YZ和ZW2所含化学键类型相同 | |
| D. | 简单离子半径:r(Y2+)<r(X-)<r(W-)<r(Z2-) |

 ,F
,F .
.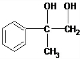 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2 +2H2O.
+2H2O.