题目内容
4.下列离子方程式或说法正确的是( )| A. | 向Fe(NO3)2和KI混合溶液中加入少量稀盐酸:3Fe2++4H++NO3-=3Fe3++2H2O+NO↑ | |
| B. | 非金属元素形成的化合物一定是共价化合物 | |
| C. | SO2通入Ca(ClO)2溶液中:SO2+Ca2++ClO-+H2O=CaSO4↓+2H++Cl- | |
| D. | 只含有共价键的物质一定是共价化合物 |
分析 A.碘离子还原性强于二价铁离子,硝酸根离子也能够氧化碘离子;
B.氯化铵为离子化合物;
C.次氯酸根离子具有强的氧化性能够氧化二氧化硫;
D.只含有共价键的化合物是共价化合物.
解答 解:A.向Fe(NO3)2和KI混合溶液中加入少量稀盐酸,酸性环境下硝酸根离子先氧化碘离子,再氧化二价铁离子,故A错误;
B.非金属元素形成的化合物不一定是共价化合物,如氯化铵为 非金属元素组成离子化合物,故B错误;
C.少量SO2通入Ca(ClO)2溶液中的离子反应为SO2+Ca2++ClO-+H2O=CaSO4↓+2H++Cl-,故C正确;
D.只含有共价键的物质不一定是共价化合物,如氢气、氯气,故D错误;
故选:C.
点评 本题考查了离子方程式的书写,明确反应实质及离子方程式书写方法是解题关键,注意硝酸根离子在酸性环境下的强氧化性,共价化合物与离子化合物区别,题目难度中等.

练习册系列答案
 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案
相关题目
7.下列有关物质(括号内为杂质)的除杂试剂和分离方法均正确的是( )
| 选项 | 被提纯的物质 | 除杂试剂 | 分离方法 |
| A | 己烷(己烯) | 溴水 | 分液 |
| B | 乙醇(乙酸) | KOH溶液 | 分液 |
| C | 苯(苯酚) | NaOH溶液 | 分液 |
| D | 甲烷(乙烯) | 酸性KMnO4溶液 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
15.U、V、W、Y是原子序数依次增大的短周期主族元素,U、Y在周期表中的相对位置如表;U元素与氧元素能形成两种无色气体;W是地壳中含量最多的金属元素.
根据题意完成下列填空:
(1)元素W的原子核外共有5种不同能级的电子.
(2)下列反应在恒容密闭容器中进行:2YO2(g)+O2(g)$?_{催化剂}^{450℃}$ 2YO3(g)+190kJ
①该反应 450℃时的平衡常数大于500℃时的平衡常数(填“大于”、“小于”或“等于”).
②下列描述中能说明上述反应已达平衡的是bd
a.ν(O2)正=2ν(YO3)逆 b.容器中气体的平均分子量不随时间而变化
c.容器中气体的密度不随时间而变化 d.容器中气体的分子总数不随时间而变化
③在一个固定容积为5L的密闭容器中充入0.20 mol YO2和0.10molO2,半分钟后达到平衡,测得容器中含YO30.18mol,则ν(O2)=0.36mol•L-1•min-1:若继续通入0.20molYO2和0,.10molO2,则平衡向正反应方向移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,0.36mol<n(YO3)<0.40mol.
(3)V的最简单气态氢化物甲的水溶液显碱性.
一定条件下,甲在恒容密闭容器中发生分解反应(正反应放向为吸热反应)并达平衡后,仅改变下表中反应条件x,下列各项中y随x的增大而增大的是bc.(选填序号).
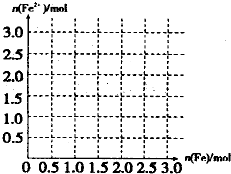
(4)向含4mol V的最高价含氧酸的稀溶液中,逐渐加入Fe粉至过量.假设生成的气体只有一种,请在坐标系中画出n(Fe2+)随n(Fe)变化的示意图.
| U | ||
| Y |
(1)元素W的原子核外共有5种不同能级的电子.
(2)下列反应在恒容密闭容器中进行:2YO2(g)+O2(g)$?_{催化剂}^{450℃}$ 2YO3(g)+190kJ
①该反应 450℃时的平衡常数大于500℃时的平衡常数(填“大于”、“小于”或“等于”).
②下列描述中能说明上述反应已达平衡的是bd
a.ν(O2)正=2ν(YO3)逆 b.容器中气体的平均分子量不随时间而变化
c.容器中气体的密度不随时间而变化 d.容器中气体的分子总数不随时间而变化
③在一个固定容积为5L的密闭容器中充入0.20 mol YO2和0.10molO2,半分钟后达到平衡,测得容器中含YO30.18mol,则ν(O2)=0.36mol•L-1•min-1:若继续通入0.20molYO2和0,.10molO2,则平衡向正反应方向移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,0.36mol<n(YO3)<0.40mol.
(3)V的最简单气态氢化物甲的水溶液显碱性.
一定条件下,甲在恒容密闭容器中发生分解反应(正反应放向为吸热反应)并达平衡后,仅改变下表中反应条件x,下列各项中y随x的增大而增大的是bc.(选填序号).
| 选项 | a | b | c | d |
| x | 温度 | 温度 | 加入H2的物质的量 | 加入甲的物质的量 |
| y | 混合气体的平均相对分子质量 | 平衡常数K | 混合气体的密度 | 达平衡时的甲的转化率 |

12. 已知:pKa=-lgKa,25℃时,H2A的pKa1=1.85,pKa2=7.19.用0.1mol•L-1 NaOH溶液滴定20mL0.1mol•L-1H2A溶液的滴定曲线如图所示(曲线上的数字为pH).下列说法不正确的是( )
已知:pKa=-lgKa,25℃时,H2A的pKa1=1.85,pKa2=7.19.用0.1mol•L-1 NaOH溶液滴定20mL0.1mol•L-1H2A溶液的滴定曲线如图所示(曲线上的数字为pH).下列说法不正确的是( )
 已知:pKa=-lgKa,25℃时,H2A的pKa1=1.85,pKa2=7.19.用0.1mol•L-1 NaOH溶液滴定20mL0.1mol•L-1H2A溶液的滴定曲线如图所示(曲线上的数字为pH).下列说法不正确的是( )
已知:pKa=-lgKa,25℃时,H2A的pKa1=1.85,pKa2=7.19.用0.1mol•L-1 NaOH溶液滴定20mL0.1mol•L-1H2A溶液的滴定曲线如图所示(曲线上的数字为pH).下列说法不正确的是( )| A. | a点所得溶液中;2n(H2A)+n(A2-)=0.002mol | |
| B. | b点所得溶液中:c(H2A)+c(H+)=c(A2-)+e(OH-) | |
| C. | C点所得溶液中:c(Na+)<3c(HA-) | |
| D. | d点所得溶液中:c(Na+)>c(A2-)>c(HA-) |
19.下列表示物质变化的式子正确的是( )
| A. | 氯气通入水中Cl2+H2O═2H++Cl-+ClO- | |
| B. | 硫化钠加入水中S2-+2H2O═H2S+2OH- | |
| C. | 冰醋酸加入水中CH3COOH+H2O?CH3COO-+H3O+ | |
| D. | 铁与水蒸气反应2Fe+3H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe2O3+3H2 |
13.下列说法中不正确的是( )
| A. | 不粘锅的内壁有聚四氟乙烯涂层,它不能使酸性高锰酸钾溶液褪色 | |
| B. | 干馏煤可以得到甲烷、苯和氨等重要化工原料 | |
| C. | 用于奥运“祥云”火炬的丙烷是一种清洁燃料 | |
| D. | 淀粉和纤维素的组成都是(C6H10O5)n,两者互为同分异构体,且水解最终产物都是葡萄糖 |
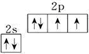 ,氧的第一电离能在同周期元素中由大到小排第4位.
,氧的第一电离能在同周期元素中由大到小排第4位.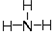 .
.

 .
.