题目内容
下列实验的现象与对应结论均正确的是( )
| 选项 | 操作 | 现象 | 结论 |
| A | 将浓硫酸滴到蔗糖表面 | 固体变黑 | 浓硫酸有吸水性 |
| B | 常温下将Al片放入浓硝酸中 | 无明显变化 | Al与浓硝酸不反应 |
| C | 将NH3通过灼热的氧化铜固体 | 固体变红 | 氨气具有还原性 |
| D | 过量的SO2通入到含有少量NaOH的酚酞溶液中 | 溶液红色逐渐褪去 | SO2具有漂白性 |
| A、A | B、B | C、C | D、D |
考点:化学实验方案的评价
专题:实验评价题
分析:A.变黑说明蔗糖脱水;
B.常温下将Al片放入浓硝酸中,发生钝化;
C.将NH3通过灼热的氧化铜固体,反应生成Cu、氮气和水;
D.二氧化硫为酸性氧化物.
B.常温下将Al片放入浓硝酸中,发生钝化;
C.将NH3通过灼热的氧化铜固体,反应生成Cu、氮气和水;
D.二氧化硫为酸性氧化物.
解答:
解:A.变黑说明蔗糖脱水,体现浓硫酸的脱水性,故A错误;
B.常温下将Al片放入浓硝酸中,发生钝化,生成致密的氧化膜阻止反应的进一步发生,发生了氧化还原反应,故B错误;
C.将NH3通过灼热的氧化铜固体,反应生成Cu、氮气和水,N元素的化合价升高,体现氨气的还原性,故C正确;
D.二氧化硫为酸性氧化物,过量的SO2通入到含有少量NaOH的酚酞溶液中,与碱反应生成盐,碱性减弱,则溶液红色逐渐褪去,与其漂白性无关,故D错误;
故选C.
B.常温下将Al片放入浓硝酸中,发生钝化,生成致密的氧化膜阻止反应的进一步发生,发生了氧化还原反应,故B错误;
C.将NH3通过灼热的氧化铜固体,反应生成Cu、氮气和水,N元素的化合价升高,体现氨气的还原性,故C正确;
D.二氧化硫为酸性氧化物,过量的SO2通入到含有少量NaOH的酚酞溶液中,与碱反应生成盐,碱性减弱,则溶液红色逐渐褪去,与其漂白性无关,故D错误;
故选C.
点评:本题考查化学实验方案的评价,为高频考点,涉及浓硫酸的性质、氧化还原反应及二氧化硫的性质等,把握物质的性质及发生化学反应为解答的关键,侧重分析能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目
已知反应:X(g)+3Y(g)?2Z(g)为放热反应,一定温度下在密闭容器中进行反应,如图是该反应达平衡及改变条件平衡移动的图象.下列说法正确的是( )


| A、图中的a、b、c、d都是平衡点 |
| B、起始时,加入Y的物质的量为1.3mol |
| C、c点和d点表示正反应速率大于逆反应速率 |
| D、在3MPa和1MPa条件下,反应达平衡时,放出的热量:Q(A)>Q(B) |
下列有关金属的工业制法中,错误的是( )
| A、制钠:以海水为原料制得NaCl,再电解熔融NaCl得钠 |
| B、制铁:以焦炭和铁矿石为原料,用CO还原铁矿石得铁 |
| C、制硅:用焦炭还原二氧化硅得硅 |
| D、制镁:以海水为原料,经一系列过程制得氯化镁,用H2还原MgCl2得镁 |
若用乙烯和氯气在适当的条件下反应制取四氯乙烷,乙烯为1mol,反应产物中的有机物只是四氯乙烷,则这一过程中所要经历的反应及耗用氯气的量是( )
| A、取代,4mol Cl2 |
| B、加成,2mol Cl2 |
| C、加成、取代,2mol Cl2 |
| D、加成、取代,3mol Cl2 |
应用元素周期律推断,下列说法正确的是( )
| A、Sr(锶)的碳酸盐难溶于水 |
| B、Tl(铊)的氢氧化物是两性氢氧化物 |
| C、H2Se比H2S更稳定 |
| D、H3AsO4酸性比H3PO4强 |
已知R+核外有18个电子.则R元素位于元素周期表的( )
| A、第三周期第ⅤA族 |
| B、第四周期第ⅠA族 |
| C、第五周期第ⅢA族 |
| D、第四周期第ⅤA族 |
在一定温度下,向a L密闭容器中加入1mol X气体和2mol Y气体,发生如下反应:X(g)+2Y(g)?2Z(g)此反应达到平衡的标志是( )
| A、正反应和逆反应的速率都为零 |
| B、容器内各物质的浓度不随时间变化 |
| C、容器内X、Y、Z的浓度之比为1:2:2 |
| D、单位时间消耗0.1mol X同时生成0.2mol Z |
最近研制出一种新材料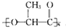 ,它能代替聚苯乙烯.它是由乳酸(一种有机酸)缩聚而成,能在乳酸菌的作用下降解而不会污染环境.下列关于聚乳酸的说法正确的是( )
,它能代替聚苯乙烯.它是由乳酸(一种有机酸)缩聚而成,能在乳酸菌的作用下降解而不会污染环境.下列关于聚乳酸的说法正确的是( )
 ,它能代替聚苯乙烯.它是由乳酸(一种有机酸)缩聚而成,能在乳酸菌的作用下降解而不会污染环境.下列关于聚乳酸的说法正确的是( )
,它能代替聚苯乙烯.它是由乳酸(一种有机酸)缩聚而成,能在乳酸菌的作用下降解而不会污染环境.下列关于聚乳酸的说法正确的是( )| A、聚乳酸是一种纯净物 |
B、聚乳酸的单体是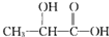 |
| C、聚乳酸是一种羧酸 |
| D、聚乳酸是由其单体通过加聚反应合成的 |

