题目内容
常温下,下列溶液中各粒子的物质的量浓度关系正确的是( )
| A、0.1mol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-) |
| B、相同条件下,pH=5的①NH4Cl溶液、②CH3COOH溶液、③稀盐酸三种溶液中由水电离出的c(H+):①>②>③ |
| C、0.2 mol/L的NaHCO3溶液与0.3mol/L的Ba(OH)2溶液等体积混合,所得溶液中:c(OH-)>c(Ba2+)>c(Na+)>c(H+) |
| D、等物质的量浓度的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-) |
考点:离子浓度大小的比较
专题:盐类的水解专题
分析:A、0.1mol/L pH为4的NaHB溶液显酸性,说明HB-为弱酸阴离子,水解程度小于电离;
B、相同条件下,pH=5的①NH4Cl溶液促进的水的电离、②CH3COOH溶液和③稀盐酸溶液是酸抑制水的电离;
C、混合后钠离子浓度大于钡离子浓度;
D、依据溶液中电荷守恒分析判断;
B、相同条件下,pH=5的①NH4Cl溶液促进的水的电离、②CH3COOH溶液和③稀盐酸溶液是酸抑制水的电离;
C、混合后钠离子浓度大于钡离子浓度;
D、依据溶液中电荷守恒分析判断;
解答:
解:A、0.1mol/L pH为4的NaHB溶液显酸性,说明HB-为弱酸阴离子,水解程度小于电离,溶液中离子浓度大小为:c(HB-)>c(B2-)>c(H2B),故A错误;
B、相同条件下,pH=5的①NH4Cl溶液促进的水的电离、②CH3COOH溶液和③稀盐酸溶液是酸抑制水的电离,三种溶液中由水电离出的c(H+):①>②=③,故B错误;
C、混合后钠离子浓度大于钡离子浓度,故C错误;
D、依据溶液中电荷守恒分析,等物质的量浓度的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-),故D正确;
故选D.
B、相同条件下,pH=5的①NH4Cl溶液促进的水的电离、②CH3COOH溶液和③稀盐酸溶液是酸抑制水的电离,三种溶液中由水电离出的c(H+):①>②=③,故B错误;
C、混合后钠离子浓度大于钡离子浓度,故C错误;
D、依据溶液中电荷守恒分析,等物质的量浓度的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-),故D正确;
故选D.
点评:本题考查了离子浓度大小比较,盐类水解分析判断,影响平衡的因素分析,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
下列有关安全措施不恰当的是( )
| A、实验室使用电器时,不能用湿手接触电器 |
| B、实验结束后,应关好水龙头、排气扇及切断电源 |
| C、未经老师允许,可以带食物进实验室,可以边做实验边吃东西 |
| D、酒精灯里的酒精不准带出实验室 |
用下列实验装置进行相应的实验,能达到实验目的是( )
A、 利用如图装置制取并收集干燥纯净的NH3 |
B、 利用如图所示装置制备可除去NO2中的NO |
C、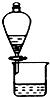 利用如图装置可分离CH3COOC2H5和饱和碳酸钠溶液 |
D、 利用如图装置制备Fe(OH)2并能较长时间观察其颜色 |
取一定质量的铜镁合金完全溶于一定体积的浓硝酸中,产生2240mL的NO2和1120mL的NO气体(标准状况下),在反应后的溶液中加足量的氢氧化钠溶液,生成的沉淀的质量可能为( )
| A、7g | B、10g |
| C、13g | D、16g |
下列有关实验原理或操作方法正确的是( )
| A、在漂白粉中滴入70%的硫酸,立即产生黄绿色气体,说明硫酸具有还原性 |
| B、实验室从海带中提取单质碘的方法:取样→灼烧→溶解→过滤→萃取 |
| C、燃料电池制作实验中,用KNO3溶液或Na2SO4溶液代替蒸馏水,效果更好 |
| D、润洗滴定管时应从滴定管上口加入润洗溶液,倾斜着转动滴定管使液体润湿内壁,再从上口倒出,重复2-3次 |
下列叙述正确的是( )
| A、电解饱和食盐水能制得NaOH |
| B、澄清石灰水能鉴别Na2CO3和NaHCO3 |
| C、配制溶液,定容时俯视容量瓶刻度会使溶液浓度偏低 |
| D、铁粉中混入少量铝粉,可加入过量的氨水后过滤除去 |
 a接电源的
a接电源的