题目内容
11.某学校化学兴趣小组为探究金属回收物的综合利用,专门设计实验用含有铝、铁、铜的合金制取纯净的AlCl3溶液和胆矾晶体(CuSO4•5H2O),其实验方案如图:
请回答下列问题:
(1)将合金研磨成合金粉的目的是增大反应物的接触面积,使反应速率加快.
(2)分别写出步骤Ⅰ、Ⅱ中发生反应的化学方程式:Ⅰ2Al+2NaOH+2H2O=2NaAlO2+3H2↑;ⅡFe+H2SO4=FeSO4+H2↑.
(3)在滤液B转化为沉淀E的过程中盐酸的用量不易控制,可将加入适量的盐酸改为通入一种气体,该气体的电子式为
 ,写出更改试剂(气体过量)后生成沉淀E所发生反应的离子方程式:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
,写出更改试剂(气体过量)后生成沉淀E所发生反应的离子方程式:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.(4)该小组成员从资料中获知H2O2是一种绿色氧化剂,在滤渣D中加入稀硫酸和H2O2可制得CuSO4,下列两种方法均可以制备CuSO4.
方法一:2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO,CuO+H2SO4═CuSO4+H2O
方法二:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O
①假如某工厂欲生产CuSO4,请选择一种方法,并说明理由:方法一,硫酸原料利用率高,对环境污染小.
②有同学认为,生成等量的硫酸铜两种方法消耗的能量相同,因为反应都是铜转变为CuSO4,你认为上述说法不正确(填“正确”或“不正确”),原因是反应物与产物不完全相同,故反应的热效应不同,消耗的能量也不同.
分析 合金中铝具有两性,能与氢氧化钠反应,故滤渣A是金属Fe和金属Cu,滤液中含有偏铝酸根离子,滤渣A中加入稀硫酸F溶解,Cu不溶解,故滤渣D使金属Cu,滤液C中含有亚铁离子,滤液B中加入适量HCl生成氢氧化铝沉淀,再加入适量盐酸变为氯化铝溶液;
(1)研磨成粉末可以增大反应物的接触面积,从化学反应速率方面考虑即可;
(2)铝、铁和铜三种金属中,只有金属铝能与氢氧化钠溶液反应,过滤后铁与稀硫酸反应生成硫酸亚铁和氢气,依据氧化还原反应原理书写方程式即可;
(3)氢氧化铝具有两性,即溶于强酸也溶于强碱,但是不溶于弱酸,据此解答即可;
(4)两种方法相比,二中生成二氧化硫污染环境,两个反应娿反应物与产物不同,则反应的热效应不同,以此来解答.
解答 解:(1)把合金研磨成合金粉,即把块状固体研磨成细小的颗粒,增大了反应物的接触面积,有利于反应进行,即加快了化学反应速率,
故答案为:增大反应物的接触面积,使反应速率加快;
(2)三种金属只有金属铝是两性金属,与氢氧化钠的溶液反应,反应生成氢气、偏铝酸钠,化学反应方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,过滤后铁与稀硫酸反应生成硫酸亚铁和氢气,反应方程式为Fe+H2SO4=FeSO4+H2↑,
故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;Fe+H2SO4=FeSO4+H2↑;
(3)偏铝酸钠溶于过量的HCl会直接生成氯化铝而得不到氢氧化铝沉淀,氢氧化铝不溶于弱酸,故利用碳酸的弱酸性代替HCl,此气体为二氧化碳,电子式为: ,偏铝酸钠中通入过量的二氧化碳气体生成氢氧化铝沉淀和碳酸氢钠,离子反应方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,
,偏铝酸钠中通入过量的二氧化碳气体生成氢氧化铝沉淀和碳酸氢钠,离子反应方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,
故答案为: ;AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
;AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(4)①两种方法相比可知,方法一,硫酸原料利用率高,对环境污染小,而方法二生成二氧化硫污染环境,则选择方法一,
故答案为:方法一,硫酸原料利用率高,对环境污染小;
②生成等量的硫酸铜两种方法消耗的能量不相同,则说法不正确,是因反应物与产物不完全相同,故反应的热效应不同,消耗的能量也不同,
故答案为:不正确;反应物与产物不完全相同,故反应的热效应不同,消耗的能量也不同.
点评 本题是对物质的分离和提纯知识点的考查,题目难度不是很大,掌握常见物质的制取方法以及氧化还原反应原理是解决本题的关键,注意整理.

 阅读快车系列答案
阅读快车系列答案| A. | 硅太阳能电池工作时将光能转化为电能 | |
| B. | 物质之间发生化学反应时都会伴随着能量变化 | |
| C. | 催化剂虽然能降低反应的活化能,但不能改变反应的焓变 | |
| D. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同 |
| A. | 不锈钢是利用牺牲阳极的阴极保护法来达到防止腐蚀的目的 | |
| B. | 明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同 | |
| C. | 研究采煤、采油新技术,尽量提高产量以满足工业生产的快速发展 | |
| D. | “绿色化学”的核心是使原料可能全部转化为目标产物 |
| A. | 利用电泳现象区别溶液和胶体 | |
| B. | 用滤纸过滤除去溶液中的胶体粒子 | |
| C. | 用渗析的方法除去胶体中的离子或分子,以净化胶体 | |
| D. | 向Fe(OH)3胶体中加入足量AgNO3溶液,以除去胶体中的CI- |
| A. | H2SO4=H22++SO42- | B. | NaHCO3=Na++H++CO32- | ||
| C. | NaOH=Na++O2-+H+ | D. | Na3PO4=3Na++PO43- |
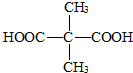 .
.
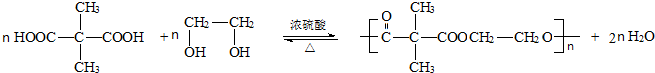 反应类型:缩聚反应.
反应类型:缩聚反应.

