题目内容
16.高铁酸钾(K2FeO4)具有很强的氧化性,是一种高效水处理剂,处理废水时,既利用其强氧化性,又利用Fe(OH)3胶体的凝聚作用.
(1)制备K2FeO4可以采用干式氧化法或湿式氧化法.
①干式氧化的初始反应是2FeSO4+6Na2O2═2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中每生成2mol Na2FeO4时转移电子10mol.
②湿式氧化法的流程如图1所示:上述流程中制备Na2FeO4的化学方程式是2Fe(NO3)3+3NaClO+10NaOH=2Na2FeO4+3NaCl+6NaNO3+5H2O;结晶过程中反应的离子方程式是2K++FeO42-=K2FeO4↓.
(2)K2FeO4在水中不稳定,发生反应:4FeO42-+10H2O?4Fe(OH)3(胶体)+8OH-+3O2,其稳定性与温度(T)和溶液pH的关系分别如图所示.
①由图2可得出的结论是K2FeO4的稳定性随着温度的升高而减弱.
②图3中a<c(填“>”、“<”、“=”),其原因是由4FeO42-+10H2O=4Fe(OH)3(胶体)+8OH-+3O2↑可知:氢离子浓度增大,平衡向正反应方向移动,高铁酸钾溶液平衡时FeO42-浓度越小,pH越小.
分析 (1)①2FeSO4+6Na2O2═2Na2FeO4+2Na2O+2Na2SO4+O2↑,6molNa2O2中12mol的负一价氧,2mol的有变成0价,还有10mol变成-2价,而铁是正2价变为正6价,所以每生成2mol Na2FeO4时转移电子10mol;
②Fe(NO3)3被NaClO氧化成Na2FeO4;结晶过程中钾离子和高铁酸根离子反应生成高铁酸钾沉淀;
(2)①温度越高,相同时间内FeO42-浓度变化越快,高铁酸钾溶液平衡时FeO42-浓度越小;温度越高FeO42-浓度越小,正向反应是吸热反应;
②pH越小,氢离子浓度越大,然后根据平衡移动解题.
解答 解:(1)①2FeSO4+6Na2O2═2Na2FeO4+2Na2O+2Na2SO4+O2↑,6molNa2O2中12mol的负一价氧,2mol的有变成0价,还有10mol变成-2价,而铁是正2价变为正6价,所以每生成2mol Na2FeO4时转移电子10mol,
故答案为:10;
②Fe(NO3)3被NaClO氧化成Na2FeO4,其反应的化学方程式为:2Fe(NO3)3+3NaClO+10NaOH=2Na2FeO4+3NaCl+6NaNO3+5H2O;结晶过程中反应的离子方程式为2K++FeO42-=K2FeO4↓,
故答案为:2Fe(NO3)3+3NaClO+10NaOH=2Na2FeO4+3NaCl+6NaNO3+5H2O;2K++FeO42-=K2FeO4↓;
(2)①由图1数据可知,温度越高,相同时间内FeO42-浓度变化越快,高铁酸钾溶液平衡时FeO42-浓度越小,温度越高FeO42-浓度越小,所以K2FeO4的稳定性随着温度的升高而减弱,
故答案为:K2FeO4的稳定性随着温度的升高而减弱;
②pH越小,氢离子浓度越大,由4FeO42-+10H2O=4Fe(OH)3(胶体)+8OH-+3O2↑可知:氢离子浓度增大,平衡向正反应方向移动,高铁酸钾溶液平衡时FeO42-浓度越小,pH越小,由图知a<c,
故答案为:<;由4FeO42-+10H2O=4Fe(OH)3(胶体)+8OH-+3O2↑可知:氢离子浓度增大,平衡向正反应方向移动,高铁酸钾溶液平衡时FeO42-浓度越小,pH越小.
点评 本题考查学生阅读题目获取信息的能力、铁的化合物的性质、氧化还原反应、化学平衡移动等,题目难度中等,要求学生要有扎实的基础知识和灵活运用知识解决问题的能力,注意基础知识的全面掌握.

| A. | 1:3 | B. | 5:1 | C. | 1:1 | D. | 1:2 |
 硫酸亚铁铵是一种浅蓝绿色晶体,俗称摩尔盐,其化学式为:FeSO4•(NH4)2SO4•6H2O.硫酸亚铁在空气中易被氧化,而形成摩尔盐后就稳定了.硫酸亚铁铵可由硫酸亚铁与硫酸铵等物质的量混合制得.三种盐的溶解度(单位为g/100g水)如表:下图是模拟工业制备硫酸亚铁铵晶体的实验装置.
硫酸亚铁铵是一种浅蓝绿色晶体,俗称摩尔盐,其化学式为:FeSO4•(NH4)2SO4•6H2O.硫酸亚铁在空气中易被氧化,而形成摩尔盐后就稳定了.硫酸亚铁铵可由硫酸亚铁与硫酸铵等物质的量混合制得.三种盐的溶解度(单位为g/100g水)如表:下图是模拟工业制备硫酸亚铁铵晶体的实验装置.| 温度/℃ | 10 | 20 | 30 | 40 | 50 | 70 |
| (NH4)2SO4 | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 | 91.9 |
| FeSO4•7H2O | 40.0 | 48.0 | 60.0 | 73.3 | - | - |
| 摩尔盐 | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 | 38.5 |
Ⅰ.
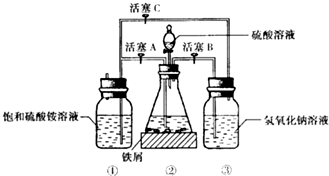
(1)先用30%的氢氧化钠溶液煮沸废铁屑(含少量油污、铁锈、FeS),再用清水洗净.用氢氧化钠溶液煮沸的目的是除去铁屑中油污
(2)将处理好的铁屑放人锥形瓶中,加入稀硫酸.锥形瓶中发生反应的离子方程式可能为ABD(填序号).
A.Fe+2H+═Fe2++H2↑ B.Fe2O3+6H+═2Fe3++3H2O
C.2Fe3++S2-═2Fe2++S↓ D.2Fe3++Fe═3Fe2+
(3)利用容器②的反应,向容器①中通入氢气,应关闭活塞A;,打开活塞BC (填字母).容器③中NaOH溶液的作用是吸收硫化氢气体,防止污染空气;向容器①中通人氢气的目的是防止亚铁离子被氧气氧化.
Ⅱ.待锥形瓶中的铁屑快反应完时,关闭、打开有关活塞继续产生的氢气会将锥形瓶中的硫酸亚铁(含极少部分未反应的稀硫酸)压到饱和硫酸铵溶液的底部.在常温下放置一段时间,试剂瓶底部将结晶出硫酸亚铁铵.
硫酸亚铁与硫酸铵溶液混合就能得到硫酸亚铁铵晶体,其原因是在相同温度下,硫酸亚铁铵的溶解度最小;从容器①中分离并得到纯净硫酸亚铁铵晶体的操作方法是过滤、用酒精洗涤、干燥.

①在步骤a中,还需要通入氧气和水,其目的是将NOx氧化成HNO3;写出化学方程式4NOx+(5-2x)O2+2H2O=4HNO3;
②在保温去铁的过程中,为使Fe3+沉淀完全,可以向溶液中加人CuO调节溶液的pH.根据下表数据,溶液的pH应保持在3.2≤pH<4.7的范围内;
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
(2)①某人设想以下图所示装置将NOx转化为硝酸,装置一可用于由N2O4制备N2O5(硝酸的酸酐),装置二用于将NO2转化为硝酸,写出通入NO2的电极的电极反应式:NO2-e-+H2O=NO3-+2H+;电解池阳极反应:N2O4+2HNO3-2e-=2N2O5+2H+.
②若通入NO2的速率为2.24L/min(标准状况),为稳定持续生产,硝酸溶液的浓度应维持质量分数50%不变,则左侧水的流入速率应为7.2mL/min.

| A. | NaH被还原 | |
| B. | NaH体现氧化性 | |
| C. | H2O既不是氧化剂又不是还原剂 | |
| D. | 若生成22.4 L标准状况下的H2,则有1 mol电子转移 |

 ,写出更改试剂(气体过量)后生成沉淀E所发生反应的离子方程式:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
,写出更改试剂(气体过量)后生成沉淀E所发生反应的离子方程式:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.