题目内容
1.按要求完成下列各题:(1)KOH的电子式:
 ,CH(CH3)3的名称为:2-甲基丙烷.
,CH(CH3)3的名称为:2-甲基丙烷.(2)有五种物质:①Cu、②H2CO3、③BaSO4、④盐酸、⑤SO2,其中弱电解质是②(填序号,下同),非电解质是⑤.
(3)钠与水反应的化学方程式为:2Na+2H2O=2NaOH+H2↑.
已知在过量的FeSO4溶液中滴入几滴NaClO溶液,并加入过量H2SO4,溶液立即变黄,试写出该反应的离子方程式:2Fe2++ClO-+2H+═2Fe3++Cl-+H2O.
分析 (1)氢氧化钾为离子化合物,电子式需要标出阴阳离子所带电荷;选最长的碳链为主链,从离支链近的一端给主链上的碳原子进行编号;
(2)在溶液中不能完全电离的电解质为弱电解质,包括弱酸、弱碱和极少数的盐;在水溶液中和熔融状态下均不能导电的化合物为非电解质;
(3)钠和水反应生成氢氧化钠和氢气;次氯酸根离子氧化二价铁离子生成三价铁离子,本身被还原为氯离子,据此写出反应方程式.
解答 解:(1)氢氧化钾为离子化合物,由钾离子和氢氧根离子构成,氢氧化钾的电子式为: ;选最长的碳链为主链,故主链上有3个碳原子,从离支链近的一端给主链上的碳原子进行编号,则在2号碳原子上有1个甲基,故此物质的名称为:2-甲基丙烷,
;选最长的碳链为主链,故主链上有3个碳原子,从离支链近的一端给主链上的碳原子进行编号,则在2号碳原子上有1个甲基,故此物质的名称为:2-甲基丙烷,
故答案为: ;2-甲基丙烷;
;2-甲基丙烷;
(2)在溶液中不能完全电离的电解质为弱电解质,包括弱酸、弱碱和极少数的盐;在水溶液中和熔融状态下均不能导电的化合物为非电解质,包括蔗糖、酒精、非金属氧化物和氨气.
①Cu是单质,故不是非电解质也不是电解质,更不是弱电解质;
②H2CO3是弱酸,故为弱电解质;
③BaSO4是盐,故为电解质,且为强电解质;
④盐酸是混合物,故不是电解质也不是非电解质,更不是弱电解质;
⑤SO2是非电解质.
故答案为:②;⑤;
(3)钠与水反应生成氢氧化钠和氢气,反应的化学方程式为:2Na+2H2O=2NaOH+H2↑;硫酸亚铁与次氯酸钠反应离子方程式:2Fe2++ClO-+2H+═2Fe3++Cl-+H2O,故答案为:2Na+2H2O=2NaOH+H2↑;2Fe2++ClO-+2H+═2Fe3++Cl-+H2O.
点评 本题考查了电解质非电解质强弱电解质的判断、有机物的命名和电子式的书写以及离子方程式书写,侧重考查氧化还原反应的离子方程式书写,明确氧化还原反应得失电子守恒规律是解题关键,注意准确分析元素化合价变化,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| 序号 | 物质(杂质) | 所用试剂 | 分离方法 |
| A | 溴苯(Br2) | 苯 | 萃取、分液 |
| B | CO2(HCl) | 饱和NaHCO3溶液 | 洗气 |
| C | C2H4(SO2) | 酸性高锰酸钾 | 洗气 |
| D | CH3CH2OH(H2O) | 生石灰 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
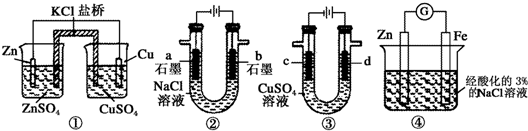
| A. | 装置①中,一段时间后左侧SO42-浓度增大 | |
| B. | 装置②中滴入酚酞,b极附近先变红 | |
| C. | 用装置③精炼铜时,c极为粗铜 | |
| D. | 装置④中在Fe电极附近滴入K3[Fe(CN)6]溶液,可验证Fe电极被保护 |
| A. | 铁原子的质量数均为60 | |
| B. | ${\;}_{26}^{60}$Fe的核内质子数比中子数多8 | |
| C. | 1mol${\;}_{26}^{58}$Fe与足量盐酸反应时均可得到1mol H2 | |
| D. | 等物质的量的${\;}_{26}^{60}$Fe与1mol ${\;}_{26}^{58}$Fe,前者质量比后者多2g |
| A. | H2 | B. | HCl | C. | KCl | D. | CO2 |
| A. | 会引起化学键的变化 | B. | 必然引起物质状态的变化 | ||
| C. | 必然伴随着能量的变化 | D. | 会产生新的物质 |

| A. | CH3COOH HCl CH3COONa | B. | H2SO4 (NH4)2SO4 CH3COONa | ||
| C. | (NH4)2SO4 CH3COOH NaOH | D. | (NH4)2SO4 NH4Cl CH3COONa |
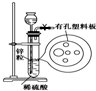 如图为实验室制氢气的简易装置.若在加稀硫酸时发现锌粒与稀硫酸没有接触而稀硫酸不够了,为使该反应顺利进行,可以从长颈漏斗中加入的试剂是( )
如图为实验室制氢气的简易装置.若在加稀硫酸时发现锌粒与稀硫酸没有接触而稀硫酸不够了,为使该反应顺利进行,可以从长颈漏斗中加入的试剂是( )
 .
.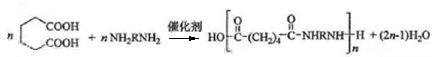 .
.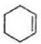 $\stackrel{溴的四氯化碳溶液}{→}$
$\stackrel{溴的四氯化碳溶液}{→}$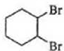 $→_{△}^{氢氧化钠/醇}$
$→_{△}^{氢氧化钠/醇}$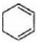 .
.