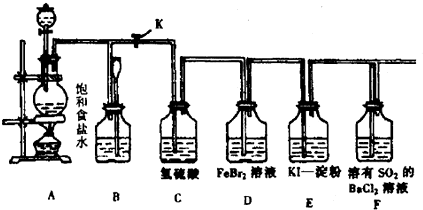
题目内容
17.NA表示阿伏伽德罗常数,下列说法正确的是( )| A. | 1molCl2与足量Fe反应,转移的电子数为3NA | |
| B. | Na2O2与CO2反应生成11.2LO2(标准状况),反应中转移的电子数为2NA | |
| C. | 在标准状况下,22.4LSO3所含的氧原子数目为3NA | |
| D. | 1molNa与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |
分析 A、氯气和铁反应后变为-1价;
B、过氧化钠与二氧化碳反应时,氧元素的价态由-1价变为0价;
C、标况下三氧化硫为固体;
D、根据钠和氧气反应后变为+1价来分析.
解答 解:A、氯气和铁反应后变为-1价,故1mol氯气反应后转移2mol电子即2NA个,故A错误;
B、过氧化钠与二氧化碳反应时,氧元素的价态由-1价变为0价,故当生成11.2L氧气即0.5mol氧气时,转移1mol电子即NA个,故B错误;
C、标况下三氧化硫为固体,故不能根据气体摩尔体积来计算其物质的量和含有的氧原子的个数,故C错误;
D、由于钠和氧气反应后变为+1价,故1mol钠失去1mol电子即NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
8.常温下,若溶液中由水电离产生的c(H+)、c(OH-)满足c(H+)•c(OH-)=10-24,则下列各组离子在该溶液中一定可以大量共存的是( )
| A. | Al3+、Na+、NO3-、Cl- | B. | K+、Na+、Cl-、NO3- | ||
| C. | K+、Na+、Cl-、AlO2- | D. | K+、NH4+、SO42-、NO3- |
5.化学研究任何一种物质的性质,都一般取用纯净物.下列物质属于纯净物的是( )
| A. | 不锈钢 | B. | 干冰 | C. | 碘酒 | D. | 空气 |
2.下列实验装置能达到实验目的是( )


| A. | 实验Ⅰ:制备少量氧气 | |
| B. | 实验Ⅱ:比较酸性强弱:H2SO4>H2CO3>H2SiO3 | |
| C. | 实验Ⅲ:分离溴的苯溶液 | |
| D. | 实验Ⅳ:观察纯碱的焰色反应 |
6.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,11.2LO2和O3组成的混合气体含有原子数为NA | |
| B. | 0.1mol•L-1Na2SO4溶液中含有Na+的个数为0.2NA | |
| C. | 常温常压下,1.7gNH3中含有的电子数目为NA | |
| D. | 5.6gFe和足量的盐酸完全反应失去电子数为0.3NA |
 依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示.
依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示.