题目内容
7.(1)写出下列物质的化学式:①足球烯:C60.②氧化铜:CuO.(2)写出Na2SO3和O2反应的化学方程式:2Na2SO3+O2=2Na2SO4.
分析 (1)足球烯为含有60个C原子的烃;氧化铜的化学式中含有1个铜离子和1个氧离子;
(2)亚硫酸钠与氧气反应生成硫酸钠,据此写出反应的化学方程式.
解答 解:(1)①足球烯分子中含有60个C原子,其分子式为:C60,
故答案为:C60;
②氧化铜为离子化合物,其化学式为:CuO,
故答案为:CuO;
(2)亚硫酸钠与氧气反应生成硫酸钠,反应的化学方程式为:2Na2SO3+O2=2Na2SO4,
故答案为:2Na2SO3+O2=2Na2SO4.
点评 本题考查了化学方程式书写、常见物质组成、名称与化学式的关系,题目难度不大,明确常见物质的组成与化学式的关系为解答关键,注意掌握化学方程式的书写原则,试题培养了学生的灵活应用能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
17.NA表示阿伏伽德罗常数,下列说法正确的是( )
| A. | 1molCl2与足量Fe反应,转移的电子数为3NA | |
| B. | Na2O2与CO2反应生成11.2LO2(标准状况),反应中转移的电子数为2NA | |
| C. | 在标准状况下,22.4LSO3所含的氧原子数目为3NA | |
| D. | 1molNa与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |
18.某校化学兴趣小组的学生,分成两组对酸雨及空气中二氧化硫的含量进行了测定.第一组,取刚降到地面的酸雨水样,进行了如下实验:
①将一片红色的玫瑰花瓣浸在一份水样中;
②向雨水试样中滴加氯化钡溶液,有白色沉淀生成;
③每隔一定时间测定其pH,数据如表Ⅰ所示.
表Ⅰ不同时间酸雨的pH
(1)一段时间后,观察到玫瑰花瓣红色变浅,原因是SO2有漂白作用.
(2)生成白色沉淀的离子方程式Ba2++SO42-=BaSO4↓.
(3)分析上述pH数据变化,你认为可能的原因是(用化学方程式表示)2SO2+2H2O+O2=2H2SO4.
第二组,拟用如图装置定量分析空气中SO2的含量:

(4)通入空气前应进行的实验操作是气密性检查;KMnO4溶液中导管末端做成球状多孔结构的作用是增大接触面积,有利于SO2的充分吸收.
(5)已知:5SO2+2MnO4-+2H2O═5SO42-+2Mn2++4H+.随着空气的不断通入,酸性高锰酸钾的溶液逐渐变浅直至褪色,说明SO2具有还原性性.
(6)若实验中气体流速aL•min-1,酸性KMnO4溶液的体积bL,其浓度为cmol•L-1,从气体通入到紫色恰好褪去,用时5min.则空气中二氧化硫的含量为$\frac{32bc}{a}$g•L-1.
①将一片红色的玫瑰花瓣浸在一份水样中;
②向雨水试样中滴加氯化钡溶液,有白色沉淀生成;
③每隔一定时间测定其pH,数据如表Ⅰ所示.
表Ⅰ不同时间酸雨的pH
| 测定时间/小时钟 | 0 | 1 | 2 | 4 |
| pH | 4.73 | 4.62 | 4.56 | 4.55 |
(2)生成白色沉淀的离子方程式Ba2++SO42-=BaSO4↓.
(3)分析上述pH数据变化,你认为可能的原因是(用化学方程式表示)2SO2+2H2O+O2=2H2SO4.
第二组,拟用如图装置定量分析空气中SO2的含量:

(4)通入空气前应进行的实验操作是气密性检查;KMnO4溶液中导管末端做成球状多孔结构的作用是增大接触面积,有利于SO2的充分吸收.
(5)已知:5SO2+2MnO4-+2H2O═5SO42-+2Mn2++4H+.随着空气的不断通入,酸性高锰酸钾的溶液逐渐变浅直至褪色,说明SO2具有还原性性.
(6)若实验中气体流速aL•min-1,酸性KMnO4溶液的体积bL,其浓度为cmol•L-1,从气体通入到紫色恰好褪去,用时5min.则空气中二氧化硫的含量为$\frac{32bc}{a}$g•L-1.
15.下列有关钠及其化合物的说法中,不正确的是( )
| A. | 钠质软,可用小刀切割 | |
| B. | 钠在空气中燃烧生成白色的过氧化钠 | |
| C. | 热的纯碱溶液可以除去铜片表面的油污 | |
| D. | 碳酸氢钠是焙制糕点所用发酵粉的主要成分之一 |
2.下列离子方程式的书写正确的是( )
| A. | 大理石与盐酸反应:CO32-+2H+═CO2↑+H2O | |
| B. | 铜和硝酸银溶液反应:Cu+Ag+═Cu2++Ag | |
| C. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| D. | 硫酸与氢氧化钡溶液反应:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O |
12.书写热化学方程式时要注明物质的状态,其主要原因是( )
| A. | 为了区别一般的化学方程式 | B. | 物质的状态与反应热有关 | ||
| C. | 可以具体说明反应进行的情况 | D. | 可以具体说明反应发生的条件 |
19.在一定温度时,N2与H2反应过程中能量变化的曲线如图,下列叙述正确的是( )

| A. | 该反应的热化学方程式为:N2+3H2?2NH3△H=-92KJ/mol | |
| B. | a曲线是加人催化剂时的能量变化曲线 | |
| C. | 加人催化剂,该化学反应的放热减少 | |
| D. | 反应物的总能量高于生成物的总能量 |
16.将1.12g铁粉加到25mL 2mol•L-1的氯化铁溶液中,完全反应后,其结果是( )
| A. | 溶液中n(Fe2+)与n(Fe3+)之比为6:1 | |
| B. | 氧化产物与还原产物的物质的量之比为2:5 | |
| C. | 铁有剩余,溶液呈浅绿色,c(Cl-)基本不变 | |
| D. | 往溶液中滴加无色KSCN溶液,不变色 |
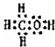 .
.