题目内容
对于可逆反应N2(g)+3H2(g)?2NH3(g)△H<0,下列各项对示意图的解释与图象相符的是( )
A、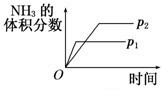 压强对反应的影响(p2>p1) |
B、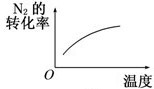 温度对反应的影响 |
C、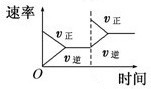 平衡体系增加N2对反应的影响 |
D、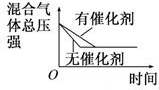 催化剂对反应的影响 |
考点:体积百分含量随温度、压强变化曲线,转化率随温度、压强的变化曲线,化学反应速率与化学平衡图象的综合应用
专题:化学平衡专题
分析:A、增大压强,合成氨的化学反应速率加快;
B、升高温度,化学反应向着逆反应方向进行,反应物转化率减小;
C、增加反应物的浓度,化学平衡向着正反应方向移动;
D、加入催化剂可以加快化反应速率,但是不会引起平衡的移动.
B、升高温度,化学反应向着逆反应方向进行,反应物转化率减小;
C、增加反应物的浓度,化学平衡向着正反应方向移动;
D、加入催化剂可以加快化反应速率,但是不会引起平衡的移动.
解答:
解:A、增大压强,合成氨的化学反应速率加快,化学平衡正向移动,根据图示知道压强应该是p2<p1,且P1条件下,氨气的百分含量更大,故A错误;
B、升高温度,化学反应向着逆反应方向进行,反应物氮气转化率减小,故B错误;
C、增加反应物的浓度,化学平衡向着正反应方向移动,正反应速率大于逆反应速率,故C正确;
D、加入催化剂可以加快化反应速率,应该是缩短达平衡的时间,但是不会引起平衡的移动,故D错误.
故选C.
B、升高温度,化学反应向着逆反应方向进行,反应物氮气转化率减小,故B错误;
C、增加反应物的浓度,化学平衡向着正反应方向移动,正反应速率大于逆反应速率,故C正确;
D、加入催化剂可以加快化反应速率,应该是缩短达平衡的时间,但是不会引起平衡的移动,故D错误.
故选C.
点评:本题考查学生影响化学平衡移动的因素:温度、压强、浓度,注意催化剂对反应速率和平衡的影响关系,难度不大.

练习册系列答案
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案
相关题目
下列分子或离子在指定的溶液中一定能大量存在的是( )
| A、常温下呈中性的溶液:Fe3+、Na+、Cl-、SO42- |
| B、1mol/L的NaAlO2溶液:NH3?H2O、CO32-、K+、SiO32- |
| C、与铝单质反应产生氢气的溶液:Na+、K+、NO3-、Mg2+ |
| D、由水电离出的c(H+)=1×10-12mol/L溶液:HCO3-、NO3-、Na+、Mg2+ |
已知C(石墨,s)═C(金刚石,s)△H>0,P(白磷,s)═P(红磷,s)△H<0.根据上述信息推论正确的是( )
| A、前者为放热反应 |
| B、红磷的能量比白磷低 |
| C、金刚石比石墨稳定 |
| D、上述变化都为物理变化 |
下列说法不正确的是( )
| A、钠之所以保存在煤油里是为了与空气隔绝,避免钠与空气中的氧气和水蒸气反应 |
| B、钠的密度比煤油大 |
| C、常温下铁不容易与水反应 |
| D、金属都能与水反应放出氢气 |
下列说法中不正确的是( )
| A、元素的化学性质主要决定于原子核外最外层电子数 |
| B、质子和中子决定原子的质量 |
| C、质子数决定元素的种类 |
| D、质量数决定原子的种类 |
下列说法中正确的是( )
| A、NaCl溶液导电,所以NaCl溶液是电解质 |
| B、固体NaCl不导电,但NaCl是电解质 |
| C、Cu能导电,所以Cu是电解质 |
| D、O2不能导电,所以O2是非电解质 |
在一定条件下,某固态化合物X受热分解的反应为:X
A↑+B↑+2C↑,测得反应后生成的混合气体的密度是同温同压下H2密度的12倍,则X的摩尔质量是( )
| ||
| A、24g/mol |
| B、50g/mol |
| C、80g/mol |
| D、96g/mol |
一定温度下,某一密闭且体积不变的容器内有可逆反应:A(g)+3B(g)?2C(g).该反应进行到一定限度后达到了化学平衡,该化学平衡的标志是( )
| A、C物质的生成速率和分解速率相等 |
| B、容器内气体的密度不再随时间而改变 |
| C、单位时间内生成amol物质A,同时生成3amol物质B |
| D、A、B、C的浓度相等 |