题目内容
下列说法不正确的是( )
| A、钠之所以保存在煤油里是为了与空气隔绝,避免钠与空气中的氧气和水蒸气反应 |
| B、钠的密度比煤油大 |
| C、常温下铁不容易与水反应 |
| D、金属都能与水反应放出氢气 |
考点:钠的化学性质,铁的化学性质
专题:金属概论与碱元素
分析:A.钠很活泼,易与空气中的氧气和水蒸气反应;
B.钠密度比煤油大;
C.常温下铁不容易与水反应,高温下,铁和水蒸气反应生成四氧化三铁;
D.不是所有金属都能与水反应,如金与水不反应.
B.钠密度比煤油大;
C.常温下铁不容易与水反应,高温下,铁和水蒸气反应生成四氧化三铁;
D.不是所有金属都能与水反应,如金与水不反应.
解答:
解:A.钠是活泼金属,钠可以和空气的氧气反应生成氧化钠,可以和水反应生成氢氧化钠和氢气,金属钠与煤油不反应,且密度比煤油大,沉于煤油底部,隔开了空气,所以钠能保存在煤油中,故A正确;
B.金属钠在煤油中,不反应,且密度比煤油大,沉于煤油底部,故B正确;
C.活泼金属在常温下与水反应,铁属于较活泼金属,常温下铁不容易与水反应,高温下,3Fe+4H2O
Fe3O4+4H2,故C正确;
D.有的不活泼金属与水不反应,如铂、金等,故D错误;
故选D.
B.金属钠在煤油中,不反应,且密度比煤油大,沉于煤油底部,故B正确;
C.活泼金属在常温下与水反应,铁属于较活泼金属,常温下铁不容易与水反应,高温下,3Fe+4H2O
| ||
D.有的不活泼金属与水不反应,如铂、金等,故D错误;
故选D.
点评:本题主要考查了金属的活动性,侧重考查了钠和铁,注意铁在常温下与水不反应,题目难度不大.

练习册系列答案
相关题目
下列判断中正确的是( )


| A、烧杯a中的溶液pH降低 |
| B、锌是化学电源的正极 |
| C、烧杯a中发生的反应为2H++2e-=H2↑ |
| D、盐桥中的阳离子向铁电极移动 |
在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g)?zC(g)平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度降低为0.30mol/L.下列有关判断不正确的是( )
| A、x+y>z |
| B、A的体积分数下降 |
| C、B的转化率降低 |
| D、C的体积分数下降 |
 W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知( )
W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知( )| A、X、Y、Z中最简单氢化物稳定性最弱的是Z |
| B、Z和Y元素的氧化物对应水化物的酸性Z一定强于Y |
| C、简单阴离子的还原性:X<Y |
| D、最简单氢化物的沸点:X<Y |
H2摩尔质量为( )
| A、2g/mol |
| B、1g/mol |
| C、4g/mol |
| D、8g/mol |
相同物质的量的下列有机物,充分燃烧,消耗氧气量相同的是( )
| A、C3H4和C2H6 |
| B、C3H6和C3H8O |
| C、C3H6O2和C3H8O |
| D、C3H8O和C4H8O2 |
对于可逆反应N2(g)+3H2(g)?2NH3(g)△H<0,下列各项对示意图的解释与图象相符的是( )
A、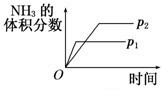 压强对反应的影响(p2>p1) |
B、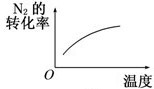 温度对反应的影响 |
C、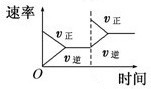 平衡体系增加N2对反应的影响 |
D、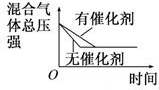 催化剂对反应的影响 |
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、2.4g金属镁变为镁离子时失去的电子数为0.2NA |
| B、2.7g金属铝所含电子数目为0.3NA |
| C、0.5 mol/LFe2(SO4)3溶液中,SO42-的数目为1.5NA |
| D、在常温常压下,11.2L Cl2含有的分子数为0.5NA |
短周期金属元素甲~戊在元素周期表中的相对位置如表,下面判断正确的是( )
| 甲 | 乙 | |
| 丙 | 丁 | 戍 |
| A、氢氧化物碱性:丙>丁>戊 |
| B、金属性:甲>丙 |
| C、原子半径:丙<丁<戊 |
| D、最外层电子数:甲>乙 |