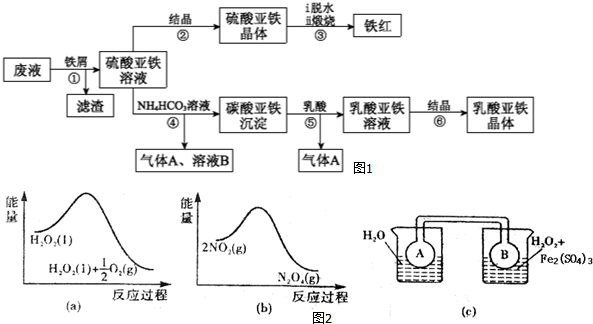
题目内容
1.三苯甲醇是一种重要的化工原料和医药中间体,实验室合成三苯甲醇[(C6H5)3COH]的合成流程如图1所示.
已知:Ⅰ)格氏试剂容易水解:
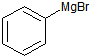 +H2O→
+H2O→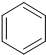 +Mg(OH)Br(碱式溴化镁)
+Mg(OH)Br(碱式溴化镁)Ⅱ)相关物质的物理性质如下:
| 物质 | 熔点 | 沸点 | 溶解性 |
| 三苯甲醇 | 164.2℃ | 380℃ | 不溶于水,溶于乙醇、乙醚等有机溶剂 |
| 乙醚 | -116.3℃ | 34.6℃ | 微溶于水,溶于乙醇、苯等有机溶剂 |
| 溴苯 | -30.7℃ | 156.2℃ | 不溶于水,溶于乙醇、乙醚等多数有机溶剂 |
| 苯甲酸乙酯 | -34.6℃ | 212.6℃ | 不溶于水 |
| Mg(OH)Br | 常温下为固体 | 能溶于水,不溶于醇、醚等有机溶剂 | |
请回答以下问题:
(1)实验室合成三苯甲醇的装置如图2,写出玻璃仪器A的名称干燥管,装有无水CaCl2的仪器A的作用是防止空气中的水蒸气进入装置,避免格氏试剂水解.
(2)制取格氏试剂时要保持微沸,可以采用水浴加热,优点是受热均匀,便于控制温度,微沸回流时冷凝管中水流的方向是X→Y(填“X→Y”或“Y→X”).
(3)制得的三苯甲醇粗产品中,含有乙醚、溴苯、苯甲酸乙酯等有机物和碱式溴化镁、氯化铵等杂质,可以设计如下提纯方案,请填写空白:
粗产品$\stackrel{操作①}{→}$$\stackrel{②溶解、过滤}{→}$$\stackrel{③洗涤、干燥}{→}$ 三苯甲醇
其中,操作①为:蒸馏;洗涤液最好选用:A.
A.水B.乙醚C.乙醇D.苯
检验产品已经洗涤干净的操作为取少量最后一次洗涤液于试管中,滴加硝酸银溶液,若无沉淀生成,则已洗涤干净,反之则未洗涤干净.
(4)纯度测定:称取2.60g产品,配成乙醚溶液,加入足量金属钠(乙醚与钠不会反应),充分反应后,测得生成气体体积为100.80mL(标准状况).产品中三苯甲醇质量分数为(保留两位有效数字).若配成乙醇溶液,来测三苯甲醇质量分数90%,结果会偏高(填“偏高”、“不变”或“偏低”).
分析 (1)图中玻璃仪器A的名称是干燥管,由于格氏试剂容易水解,A的作用是防止空气中的水蒸气进入装置;
(2)利用水浴加热,受热均匀,便于控制温度;冷凝管内水流的方向和气流的方向是相反的;
(3)三苯甲醇粗产品中含有乙醚、溴苯、苯甲酸乙酯等有机物,三苯甲醇的沸点最高,所以先用蒸馏的方法除去有机杂质;碱式溴化镁溶于水,不溶于有机溶剂,所以洗涤液选用水;检查洗涤是否干净,取少量最后一次洗涤液于试管中,用硝酸银溶液检验是否含有溴离子;
(4)由2-OH~H2可计算出三苯甲醇的物质的量,再根据m=nM计算三苯甲醇的质量,进而计算产品中三苯甲醇的质量分数.
解答 解:(1)图中玻璃仪器A的名称是干燥管,由于格氏试剂容易水解,A的作用是防止空气中的水蒸气进入装置,避免格式试剂水解,
故答案为:干燥管;防止空气中的水蒸气进入装置,避免格氏试剂水解;
(2)采用水浴加热,受热均匀,便于控制温度,冷凝管内水流的方向和气流的方向是相反的;微沸回流时冷凝管中水流的方向是X到Y,
故答案为:受热均匀,便于控制温度;X→Y;
(3)三苯甲醇粗产品中含有乙醚、溴苯、苯甲酸乙酯等有机物,三苯甲醇的沸点最高,所以先用蒸馏或分馏的方法除去有机杂质;
由于碱式溴化镁溶于水,不溶于有机溶剂,所以洗涤液选用水,故选a;
检查洗涤是否干净的一般步骤是:取少量最后一次洗涤液于试管中,滴加硝酸银溶液,若无沉淀生成,则已洗涤干净,反之则未洗涤干净,
故答案为:蒸馏或分馏;A;取少量最后一次洗涤液于试管中,滴加硝酸银溶液,若无沉淀生成,则已洗涤干净,反之则未洗涤干净;
(4)由2-OH~H2,可知三苯甲醇的物质的量是 $\frac{0.1008L}{22.4L/mol}$×2=0.009mol,所以产品中三苯甲醇的质量是0.009mol×260g/mol=2.34g,则产品中三苯甲醇的质量分数=$\frac{2.34g}{2.60g}$×100%=90%,若配成乙醇溶液,来测三苯甲醇质量分数,金属钠可以和乙醇之间反应,所以结果会偏高.
故答案为:90%;偏高.
点评 本题考查有机物合成实验、物质的分离与洗涤等基本操作、对实验装置的分析评价等,较好的考查学生对数据的应用、阅读获取信息的能力以及知识迁移应用,难度大.

| 容器编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
| X2 | Y2 | XY3 | ||
| ① | 1 | 3 | 0 | 放热46.3 kJ |
| ② | 0.8 | 2.4 | 0.4 | Q(Q>0) |
| A. | 容器①中达到平衡时,Y2的转化率为50% | |
| B. | Q=27.78kJ | |
| C. | 容器①、②中反应的平衡常数相等,K=$\frac{16}{27}$ | |
| D. | 相同温度下;起始时向容器中充入1.0X2mol、3.0molY2和2molXY3;反应达到平衡前v(正)>v(逆) |
| A. | c1:c2=1:3 | |
| B. | 当4v(X)正=v(Y)逆时,该反应还在向逆反应方向建立平衡 | |
| C. | X、Y的转化率不相等 | |
| D. | Y起始浓度c2可能为0.36mol/L |
| A. | 10% | B. | 25% | C. | 50% | D. | 67% |
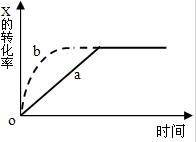 图中曲线a表示放热反应X(g)+Y(g)?Z(g)+N(s)进行过程中X的转化率随时间变化的关系,若只改变一个起始条件,使反应过程按b曲线进行,可采取的措施是( )
图中曲线a表示放热反应X(g)+Y(g)?Z(g)+N(s)进行过程中X的转化率随时间变化的关系,若只改变一个起始条件,使反应过程按b曲线进行,可采取的措施是( )| A. | 升高温度 | B. | 加大X的投入量 | C. | 使用催化剂 | D. | 缩小体积 |
①CH3OH(g)+H2O(g)═CO2(g)+3H2(g)△H=+49.0kJ/mol
②CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)△H=-192.9kJ/mol
下列说法正确的是( )
| A. | CH3OH的燃烧热为192.9kJ/mol | |
| B. | 反应①要吸收热量,故反应②更实用些 | |
| C. | CH3OH转变成H2的过程一定要吸收能量 | |
| D. | 根据②推知反应:CH3OH(l)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)的△H>-192.9kJ/mol |

| A. | 原溶液中c(Fe3+)=0.2mol•L-1 | |
| B. | SO42-、NH4+、Na+一定存在,CO32-一定不存在 | |
| C. | 要确定原溶液中是否含有Fe2+,其操作为取少量原溶液于试管中,加KSCN溶液,再加入适量氯水,溶液呈血红色,则含有Fe2+ | |
| D. | 溶液中至少有4种离子存在,其中Cl-一定存在,且c(Cl-)≥0.2mol•L-1 |