题目内容
氨在国民经济中占有重要的地位.传统哈伯法合成氨工艺为N2(g)+3H2(g)
2NH3(g)△H<0.若该反应在0.5L的定容密闭容器中进行.
(1)该反应的化学平衡常数表示式为K= ,升高温度,K值 (填“增大”“减小”或“不变”).
(2)下列关于合成氨说法正确的是 (填字母).
A.使用催化剂可以提高NH3的产率
B.寻找常温下的合适催化剂是未来研究的方向
C.由于△H<0,故合成氨反应一定能自发进行
D.从勒夏特列原理考虑,500℃比室温更有利于合成氨反应
(3)下列能判断该反应达到化学平衡状态的依据是 (填字母).
A.每断裂1mol氮氮键同时断裂2mol氮氢键
B.混合气体中c(H2)不变
C.3υ逆( H2)=υ正(N2)
D.容器内混合气体的压强不随时间变化而变化
(4)已知400℃时该反应的K=0.5.投入原料反应一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应υ逆( N2) υ正(N2)(选填<、>、=、不能确定)
(5)在三个相同容器中各充入1molN2和3molH2,在不同条件下反应达到平衡,氨的体积分数随时间变化曲线如图.下列说法正确的是 .
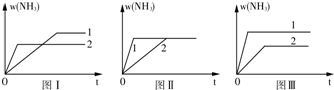
A.图Ⅰ可能是不同压强对反应的影响,且p2>p1
B.图Ⅱ可能是不同压强对反应的影响,且p1>p2
C.图Ⅲ可能是不同温度对反应的影响,且T1>T2
D.图Ⅱ可能是同温同压下不同催化剂对反应的影响,且催化剂性能:1>2.
| 催化剂 |
| 高温高压 |
(1)该反应的化学平衡常数表示式为K=
(2)下列关于合成氨说法正确的是
A.使用催化剂可以提高NH3的产率
B.寻找常温下的合适催化剂是未来研究的方向
C.由于△H<0,故合成氨反应一定能自发进行
D.从勒夏特列原理考虑,500℃比室温更有利于合成氨反应
(3)下列能判断该反应达到化学平衡状态的依据是
A.每断裂1mol氮氮键同时断裂2mol氮氢键
B.混合气体中c(H2)不变
C.3υ逆( H2)=υ正(N2)
D.容器内混合气体的压强不随时间变化而变化
(4)已知400℃时该反应的K=0.5.投入原料反应一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应υ逆( N2)
(5)在三个相同容器中各充入1molN2和3molH2,在不同条件下反应达到平衡,氨的体积分数随时间变化曲线如图.下列说法正确的是

A.图Ⅰ可能是不同压强对反应的影响,且p2>p1
B.图Ⅱ可能是不同压强对反应的影响,且p1>p2
C.图Ⅲ可能是不同温度对反应的影响,且T1>T2
D.图Ⅱ可能是同温同压下不同催化剂对反应的影响,且催化剂性能:1>2.
考点:化学平衡常数的含义,化学平衡状态的判断,体积百分含量随温度、压强变化曲线
专题:化学平衡专题
分析:(1)依据化学方程式书写平衡常数表达式,用生成物平衡浓度的幂次方乘积除以反应物平衡浓度的幂次方乘积;反应是放热反应,升温平衡逆向进行;
(2)A.使用催化剂改变反应速率,不能改变化学平衡;
B.合适的催化剂加快反应速率,寻找常温下的合适催化剂是未来研究的方向;
C.由于反应△H<0,△S<0,高温下不能自发进行;
D.从勒夏特列原理考虑,500℃比室温更有利于合成氨反应是因为此温度下催化剂活性最大,具有一定的反应速率,升温平衡逆向进行;
(3)依据平衡状态标志是正逆反应速率相同,各组分含量保持不变分析选项;
(4)依据浓度商计算和 平衡常数比较分析判断反应进行方向;
(5)A.增大压强平衡右移;
B.压强不同,平衡状态不同;
C.升高温度平衡逆向移动;
D.催化剂不影响平衡移动.
(2)A.使用催化剂改变反应速率,不能改变化学平衡;
B.合适的催化剂加快反应速率,寻找常温下的合适催化剂是未来研究的方向;
C.由于反应△H<0,△S<0,高温下不能自发进行;
D.从勒夏特列原理考虑,500℃比室温更有利于合成氨反应是因为此温度下催化剂活性最大,具有一定的反应速率,升温平衡逆向进行;
(3)依据平衡状态标志是正逆反应速率相同,各组分含量保持不变分析选项;
(4)依据浓度商计算和 平衡常数比较分析判断反应进行方向;
(5)A.增大压强平衡右移;
B.压强不同,平衡状态不同;
C.升高温度平衡逆向移动;
D.催化剂不影响平衡移动.
解答:
解:(1)N2(g)+3H2(g)
2NH3(g)△H<0,平衡常数K=
,反应是放热反应,升高温度平衡逆向进行,平衡常数减小,
故答案为:
;减小;
(2)A.使用催化剂改变反应速率,不能改变化学平衡,不能提高NH3的产率,故A不符合;
B.合适的催化剂加快反应速率,寻找常温下的合适催化剂是未来研究的方向,故B符合;
C.由于反应△H<0,△S<0,高温下不能自发进行,故C不符合;
D.从勒夏特列原理考虑,500℃比室温更有利于合成氨反应是因为此温度下催化剂活性最大,具有一定的反应速率,升温平衡逆向进行,故D不符合;
故选B;
(3)N2(g)+3H2(g)
2NH3(g),则
A.每断裂1mol氮氮键同时断裂2mol氮氢键,不符合反应正逆反应速率相同,应是每断裂1mol氮氮键同时断裂6mol氮氢键符合,故A错误;
B.混合气体中c(H2)不变是平衡标志,故B正确;
C.化学反应速率之比等于化学方程式系数之比,是正反应速率之比,当υ逆( H2)=3υ正(N2)反应达到平衡状态,故3υ逆( H2)=υ正(N2)不能说明费用达到平衡状态,故C错误;
D.反应前后气体体积变化,容器内混合气体的压强不随时间变化而变化,说明反应达到平衡状态,故D正确;
故答案为:BD;
(4)若该反应在0.5L的定容密闭容器中进行,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,N2、H2、NH3的物质的量浓度分别为4mol/L、2mol/L、4mol/L时,Qc=
=0.5,所以该状态是平衡状态,正逆反应速率相等,故答案为:=;
(5)A.增大压强平衡右移,氨气的含量应增大,故A错误;
B.压强不同,平衡状态不同,不可能在同一平衡状态,故B错误;
C.升高温度平衡逆向移动,氨气的含量减小,故C错误;
D.催化剂不影响平衡移动,由图象可知催化剂性能,1>2,故D正确.
故答案为:D.
| 催化剂 |
| 高温高压 |
| c2(NH3) |
| c(N2)c3(H2) |
故答案为:
| c2(NH3) |
| c(N2)c3(H2) |
(2)A.使用催化剂改变反应速率,不能改变化学平衡,不能提高NH3的产率,故A不符合;
B.合适的催化剂加快反应速率,寻找常温下的合适催化剂是未来研究的方向,故B符合;
C.由于反应△H<0,△S<0,高温下不能自发进行,故C不符合;
D.从勒夏特列原理考虑,500℃比室温更有利于合成氨反应是因为此温度下催化剂活性最大,具有一定的反应速率,升温平衡逆向进行,故D不符合;
故选B;
(3)N2(g)+3H2(g)
| 催化剂 |
| 高温高压 |
A.每断裂1mol氮氮键同时断裂2mol氮氢键,不符合反应正逆反应速率相同,应是每断裂1mol氮氮键同时断裂6mol氮氢键符合,故A错误;
B.混合气体中c(H2)不变是平衡标志,故B正确;
C.化学反应速率之比等于化学方程式系数之比,是正反应速率之比,当υ逆( H2)=3υ正(N2)反应达到平衡状态,故3υ逆( H2)=υ正(N2)不能说明费用达到平衡状态,故C错误;
D.反应前后气体体积变化,容器内混合气体的压强不随时间变化而变化,说明反应达到平衡状态,故D正确;
故答案为:BD;
(4)若该反应在0.5L的定容密闭容器中进行,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,N2、H2、NH3的物质的量浓度分别为4mol/L、2mol/L、4mol/L时,Qc=
| 42 |
| 4×23 |
(5)A.增大压强平衡右移,氨气的含量应增大,故A错误;
B.压强不同,平衡状态不同,不可能在同一平衡状态,故B错误;
C.升高温度平衡逆向移动,氨气的含量减小,故C错误;
D.催化剂不影响平衡移动,由图象可知催化剂性能,1>2,故D正确.
故答案为:D.
点评:本题考查考查化学平衡移动的问题,侧重于化学平衡移动的综合考查,题目难度不大,注意把握平衡常数的意义.

练习册系列答案
相关题目
下列离子组能大量共存且溶液为无色透明的是( )
| A、H+、K+、Cl-、HCO3- |
| B、H+、Na+、Cu2+、SO42- |
| C、H+、Mg2+、SO42-、Cl- |
| D、H+、Fe2+、NO3-、K+ |
下列离子方程式书写正确的是( )
| A、AlCl3溶液滴加过量的氨水:Al3++4NH3?H2O═AlO2-+4NH4++H2O |
| B、硫酸和氢氧化钡溶液反应:H++SO42-+OH-+Ba2+═BaSO4↓+H2O |
| C、向氯化钙溶液中通入CO2气体:Ca2++CO2+H2O═CaCO3↓+2H+ |
| D、向氢氧化铁胶体中滴加足量HI溶液:2Fe(OH)3+6H++2I-═2Fe2++I2+6H2O |
下列说法不正确的是( )
| A、霾的形成与PM2.5有直接关系 |
| B、自行车钢架生锈主要是电化学腐蚀所致 |
| C、用加热的方法杀死H7N9禽流感病毒是采用了蛋白质变性原理 |
| D、人类在研究物质微观结构的过程中,扫描隧道显微镜、光学显微镜、电子显微镜先后得到了使用 |
下列有机物中没有同分异构体的是( )
| A、溴乙烷 | B、二溴乙烷 |
| C、已烯 | D、二甲苯 |
 已知溶液中,还原性为HSO3->I-,氧化性为IO3->I2>SO42-.
已知溶液中,还原性为HSO3->I-,氧化性为IO3->I2>SO42-.