题目内容
17.随着原子序数的递增,八种短周期元素原子半径的相对大小和最高正价或最低负价如图所示.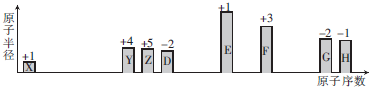
(1)元素Z位于元素周期表的第二周期Ⅴ族,X与Z可形成18电子的化合物,该化合物的电子式为
 .
.(2)非金属性:Y>(填“>”“<”或“=”)D.
(3)单质F与EDX溶液反应的化学化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
(4)G和H可形成一种化合物,其相对分子质量在90~110之间.且G的质量分数约为31.1%,该化合物的化学式为SCl2.
分析 从图中的化合价、原子半径的大小及原子序数,可知X是H元素,Y是C元素,Z是N元素,D是O元素,E是Na元素,F是Al元素,G是S元素,H是Cl元素;
(1)根据元素在周期表中的位置结合电子式的书写方法来回答;
(2)同周期从左到右原子半径逐渐减小;
(3)铝能够与强碱溶液反应,如:铝与氢氧化钠溶液反应生成偏铝酸钠和氢气;
(4)G是S元素,H是Cl元素,其相对分子质量在90~110之间.且S的质量分数约为31.1%,据此列式计算元素的原子个数比.
解答 解:从图中的化合价、原子半径的大小及原子序数,可知X是H元素,Y是C元素,Z是N元素,D是O元素,E是Na元素,F是Al元素,G是S元素,H是Cl元素.
(1)Z是N元素,位于元素周期表的第二周期,第ⅤA族,X是H元素,X与Z形成18电子的化合物为:N2H4,属于共价化合物,该化合物的电子式为

(2)Y是C元素,D是O元素,同周期从左到右原子半径逐渐减小,所以Y>D,故答案为:>;
(3)单质F(Al)与EDX(NaOH)溶液反应的化学化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(4)G是S元素,H是Cl元素,形成的化合物中S显示正价,Cl显示负价,S的质量分数约为31.1%,则S和Cl原子个数比为$\frac{31.1%}{32}$:$\frac{68.9%}{35.5}$=1:2,其相对分子质量在90~110之间,设化学式为(SCl2)x,当x=1时,(32+71)×1=103,满足相对分子质量在90~110之间,故答案为:SCl2.
点评 本题考查结构性质位置关系应用,根据化合价与原子半径推断元素是解题关键,注意对元素周期律的理解掌握.

 阅读快车系列答案
阅读快车系列答案(1)向甲试管中加入NaOH溶液,上述平衡向方向正反应移动(填“正反应”或“逆反应”);
(2)向乙试管中加入足量Ba(NO3)2溶液(已知BaCrO4为黄色沉淀),溶液最终显无色.
| t/℃ | 5 | 15 | 25 | 35 | 50 |
| K | 1100 | 841 | 680 | 533 | 409 |
| A. | 含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为: NaOH(aq)+CH3COOH(aq)═CH3COONa(aq)+H2O(l)△H=-57.4kJ•mol-1 | |
| B. | 已知C(石墨,s)═C(金刚石,s)△H>0,则石墨比金刚石稳定 | |
| C. | 已知反应2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1,则H2的燃烧热为571.6kJ•mol-1 | |
| D. | 已知2C(s)+2O2(g)═2CO2(g)△H1;2C(s)+O2(g)=2CO(g)△H2,则△H1>△H2 |
| A. | 7:5 | B. | 3:7 | C. | 7:1 | D. | 1:7 |
| A. | 标准状况下,22.4 L H2O含有的分子数为 NA | |
| B. | 16 g O2和O3组成的混合气体中含有的原子数为 NA | |
| C. | 1 mol•L-1A1Cl3溶液中含有的Cl-数目为3 NA | |
| D. | 2.3 g Na与足量水反应,转移的电子数目为0.2 NA |
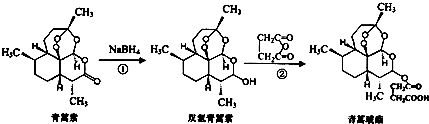
| A. | 青蒿素分子式为C15H22O5 | |
| B. | 青蒿素不能与NaOH溶液反应 | |
| C. | 反应②原子利用率为100% | |
| D. | 青蒿琥酯能与氢氧化钠溶液反应可生成青蒿琥酯钠 |
| A. | CO2通入可溶性硅酸盐中析出硅酸沉淀,所以硅酸的酸性大于碳酸 | |
| B. | 为防止中秋月饼等富脂食品因被氧化而变质,常在包装袋中放入生石灰或硅胶 | |
| C. | 一块表面已被氧化为Na2O的钠块10.8g,将其投入100g水中,产生H2 0.2g,则被氧化的钠是4.6g | |
| D. | 生成一种单质和一种化合物的反应一定是置换反应 |
| A. | 等质量的两物质分别与足量盐酸充分反应时,NaHCO3产生CO2气体多 | |
| B. | 可以用澄清石灰水或者氢氧化钠溶液区别 | |
| C. | 等质量的两物质分别与足量的等浓度盐酸反应时,一般是Na2CO3产生CO2气体快 | |
| D. | NaHCO3中Na2CO3混有杂质可以用加热方法除去 |