题目内容
10.在水溶液中橙色的Cr2O72-与黄色的CrO42-存在如下平衡:Cr2O72-+H2O?2CrO42-+2H+,已知重铬酸钾(K2Cr2O7)稀溶液为橙色.取甲、乙两支试管分别加入2mL重铬酸钾稀溶液,进行如下操作:(1)向甲试管中加入NaOH溶液,上述平衡向方向正反应移动(填“正反应”或“逆反应”);
(2)向乙试管中加入足量Ba(NO3)2溶液(已知BaCrO4为黄色沉淀),溶液最终显无色.
| t/℃ | 5 | 15 | 25 | 35 | 50 |
| K | 1100 | 841 | 680 | 533 | 409 |
分析 在水溶液中橙色的Cr2O72-与黄色的CrO42-存在如下平衡:Cr2O72-+H2O?2CrO42-+2H+,当改变一个条件,平衡会向减弱这种改变的方向进行,
(1)向甲试管中加入NaOH溶液,中和氢离子,氢离子浓度降低,平衡正向移动;
(2)向乙试管中加入足量Ba(NO3)2溶液,溶液中钡离子结合CrO42-形成BaCrO4为黄色沉淀,平衡正向进行;
解答 解:(1)向甲试管中加入NaOH溶液,中和平衡状态下的氢离子,氢离子浓度降低,平衡正向移动,所以上述平衡向方向正反应,
故答案为:正反应;
(2)向乙试管中加入足量Ba(NO3)2溶液,溶液中钡离子不断结合CrO42-形成BaCrO4为黄色沉淀,促使平衡正向进行彻底,最后溶液显无色,
故答案为:无;
点评 本题考查化学平衡的影响因素,比较基础,注意对化学平衡移动原理的理解和应用,熟练掌握基础知识是解题关键.

练习册系列答案
相关题目
5.固体X中可能含有MgCl2、Na2CO3、K2SO3、KAlO2中的一种或几种.为确定该固体粉末的成分,现取X进行下列实验,实验过程及现象如图,根据实验,下列说法错误的是( )

| A. | 气体1可能为NO和CO2的混合物 | |
| B. | 沉淀3可能为Mg(OH)2和Al(OH)3的混合物 | |
| C. | 沉淀4可能为BaCO3、BaSO3或二者混合物 | |
| D. | X中一定有K2SO3,可能有KAlO2 |
15.燃料电池是一种利用能源物质的新的形式,比如我们可用熔融的K2CO3作电解质,惰性材料作电极,一极通CH2=CH2,另一极通O2、CO2下列说法中不正确的是( )
| A. | 正极发生的电极反应为:3O2+6CO2+12e-═6CO${\;}_{3}^{2-}$ | |
| B. | 通入乙烯的一极为正极 | |
| C. | 负极发生的电极反应为:CH2=CH2+6CO${\;}_{3}^{2-}$-12e-═8CO2+2H2O | |
| D. | 电池的总反应式为:CH2=CH2+3O2═2CO2+2H2O |
2.下列有关反应限度的叙述正确的是( )
| A. | 大多数化学反应在一定条件下都有一定的限度 | |
| B. | 当可逆反应达到反应限度时,反应会自动停止 | |
| C. | 使用催化剂,可降低反应的活化能,加快反应速率,改变反应限度 | |
| D. | FeCl3与KSCN反应达到平衡时,向其中加少量KCl固体,则溶液颜色变深 |
19.有些金属元素只能通过焰色反应才能鉴定如K、Na,做焰色反应实验所用的铂丝每次用完后都必须洗净,下列溶液可以用来洗铂丝的是( )
| A. | 稀H2SO4 | B. | 稀HNO3 | C. | 浓H2SO4 | D. | 稀HCl(aq) |
 B.H2O:0.002mol•L﹣1
B.H2O:0.002mol•L﹣1 CO2(g)+Cu(s)和反应②:H2(g)+CuO(s)
CO2(g)+Cu(s)和反应②:H2(g)+CuO(s) O2)•c(Cu)]/[c(CO)•c(CuO)]
O2)•c(Cu)]/[c(CO)•c(CuO)] N204(g) △H=一57kJ·mol—1。在温度为T1、T2时,平衡体系中N02的体积分数随压强变化的曲线如图所示。下列说法正确的是 ( )
N204(g) △H=一57kJ·mol—1。在温度为T1、T2时,平衡体系中N02的体积分数随压强变化的曲线如图所示。下列说法正确的是 ( )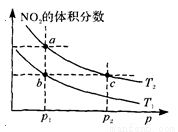
 .
.