题目内容
16.下列说法正确的是( )| A. | 所有自发进行的化学反应都是放热反应 | |
| B. | 高温高压下可以使石墨转化为金刚石是自发的化学反应 | |
| C. | 由能量判据和熵判据组合而成的复合判据,将更适合于所有的过程 | |
| D. | 同一物质的固、液、气三种状态的熵值相同 |
分析 A.反应能否自发取决于焓变和熵变的复合判据;
B.石墨能量低于金刚石,在给定的条件下,无须外界做功,一经引发即能自动进行的化学反应为自发进行的反应;
C.△G=△H-T•△S<0时,反应能自发进行;
D.同一物质的固、液、气三种状态的熵值依次增大.
解答 解:A.反应能否自发取决于焓变和熵变的复合判据,对于某些吸热反应,在一定温度下也能进行,故A错误;
B.C(石墨)=C(金刚石);通常状况下△H>0,△S<0,反应是不自发的,而且将金刚石加热到1000℃可以变成石墨,故B错误;
C.复合判据△G=△H-T•△S<0时,反应能自发进行,适合于所有的过程,故C正确;
D.同一物质的固、液、气三种状态的熵值依次增大,故D错误;
故选C.
点评 本题考查反应热与焓变和化学反应进行的方向,题目难度不大,注意把握化学反应进行自发性的判断依据的理解.

练习册系列答案
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案
相关题目
6.下列说法不正确的是( )
| A. | 常温下,pH=13的NaOH溶液与pH=1的醋酸溶液等体积混合后所得溶液的pH>7 | |
| B. | 叠氮酸(HN3)与醋酸酸性相似,NaN3水溶液中离子浓度大小顺序为c(Na+)>c(N3-)>c(OH-)>c(H+) | |
| C. | 常温下,向氨水中逐滴滴入盐酸至溶液的pH=7,则混合液中c(NH4+)=c(Cl-) | |
| D. | 0.2 mol•L-1的NaHCO3溶液中:c(Na+)>c(HCO3-)>c(OH-)>c(H+) |
4.今年入冬以来,银川雾霾天气频繁出现,空气质量很差,严重影响市民的生活和健康.其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等.因此,对PM2.5、SO2、NOx等进行研究具有重要意义.请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样.
若测得该试样所含水溶性无机离子的化学组分及其平均浓度如表:
根据表中数据判断PM25的酸碱性为酸性,试样的pH=4.
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料.已知:H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8kJ•mol-1
C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5kJ•mol-1
写出焦炭与水蒸气反应的热化学方程式:C(s)+H2O(g)=CO(g)+H2(g)△H=+13l.3kJ•mol-1.
②洗涤含SO2的烟气.以下物质可作洗涤剂的是a、b.
a.Ca(OH)2 b.Na2CO3 c.CaCl2d.NaHSO3
(3)汽车尾气中NOx和CO的生成及转化
①已知汽缸中生成NO的反应为:N2(g)+O2(g)?2NO(g)△H>0若1mol空气含0.8molN2和0.2molO2,1300℃时在密闭容器内反应达到平衡,测得NO为8×10-4mol.计算该温度下的平衡常数K=4×10-6.汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是温度升高,反应速率加快,平衡右移.
②目前,在汽车尾气系统中安装催化转化器可减少CO和NO的污染,反应方程式为2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2.
(1)将PM2.5样本用蒸馏水处理制成待测试样.
若测得该试样所含水溶性无机离子的化学组分及其平均浓度如表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料.已知:H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8kJ•mol-1
C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5kJ•mol-1
写出焦炭与水蒸气反应的热化学方程式:C(s)+H2O(g)=CO(g)+H2(g)△H=+13l.3kJ•mol-1.
②洗涤含SO2的烟气.以下物质可作洗涤剂的是a、b.
a.Ca(OH)2 b.Na2CO3 c.CaCl2d.NaHSO3
(3)汽车尾气中NOx和CO的生成及转化
①已知汽缸中生成NO的反应为:N2(g)+O2(g)?2NO(g)△H>0若1mol空气含0.8molN2和0.2molO2,1300℃时在密闭容器内反应达到平衡,测得NO为8×10-4mol.计算该温度下的平衡常数K=4×10-6.汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是温度升高,反应速率加快,平衡右移.
②目前,在汽车尾气系统中安装催化转化器可减少CO和NO的污染,反应方程式为2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2.
5.关于甲酸(HCOOH)的下列性质中,不能证明它是弱电解质的是( )
| A. | 把pH=2的甲酸溶液稀释100倍后pH=3.5 | |
| B. | 0.1 mol•L-1的甲酸溶液的pH约为2 | |
| C. | HCOONa溶液能使酚酞试液变红 | |
| D. | 50mL l mol•L-1的甲酸溶液恰好与50mL l mol•L-1的NaOH溶液完全反应 |
 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a,X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a,X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
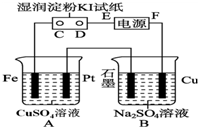 用如图所示的装置进行电解.通电一会儿,发现用NaCl溶液湿润的淀粉KI试纸的C端变为蓝色.
用如图所示的装置进行电解.通电一会儿,发现用NaCl溶液湿润的淀粉KI试纸的C端变为蓝色.