题目内容
由常见短周期元素形成的纯净物A、B、C、D、E、F、X之间的转化关系如图所示.其中B、X为单质,D在常温下为无色液体,A、B中含同一种元素(某些产物可能略去).

请回答下列问题:
(1)若气体E是大气污染物,可形成酸雨,F为一元强酸.
①写出A的电子式: ;稳定性:A D(填“>”、“<”或“=”).
②反应①的化学方程式为: .
③在反应③中,氧化剂与还原剂物质的量之比为: .
④有人认为“浓H2SO4可以干燥气体E”.某同学为了验证该观点是否正确,将气体E通过盛有浓硫酸的洗气瓶,并未发现有气体逸出,且浓H2SO4由无色变为红棕色.由此得出的结论是: .
⑤在常温下,向V1L pH=a的A溶液中加入V2L pH=b的盐酸,且a+b=14,若反应后溶液的pH<7,则V1 V2(填“>”、“<”、“=”或“无法确定”).
(2)若气体E不是大气污染物,F为二元弱酸.
①写出E的结构式: .
②在一定温度下,将少量气体E通入足量氢氧化钡溶液中得不溶物F,F的KSP=8.1×10-9mol2?L-2.现将该沉淀放入0.1mol?L-1的BaCl2溶液中,则其KSP (填“增大”、“减小”或“不变”);此时F的阴离子在溶液中的物质的量浓度为 mol?L-1.

请回答下列问题:
(1)若气体E是大气污染物,可形成酸雨,F为一元强酸.
①写出A的电子式:
②反应①的化学方程式为:
③在反应③中,氧化剂与还原剂物质的量之比为:
④有人认为“浓H2SO4可以干燥气体E”.某同学为了验证该观点是否正确,将气体E通过盛有浓硫酸的洗气瓶,并未发现有气体逸出,且浓H2SO4由无色变为红棕色.由此得出的结论是:
⑤在常温下,向V1L pH=a的A溶液中加入V2L pH=b的盐酸,且a+b=14,若反应后溶液的pH<7,则V1
(2)若气体E不是大气污染物,F为二元弱酸.
①写出E的结构式:
②在一定温度下,将少量气体E通入足量氢氧化钡溶液中得不溶物F,F的KSP=8.1×10-9mol2?L-2.现将该沉淀放入0.1mol?L-1的BaCl2溶液中,则其KSP
考点:无机物的推断
专题:推断题
分析:(1)B、X为单质,B能与X连续反应得到E,E气体是大气污染物,与水反应得到F是一元强酸,则F为HNO3,可推知,B为N2,C为NO,D为NO2,;A与氧气反应得到D与NO,常温下D为无色液体,且A、B含同一种元素,故A为NH3、D为H2O;
(2)B、X为单质,B能与X连续反应得到E,若E气体不是大气污染物,与水反应得到F是二元弱酸,则F为碳酸,B为碳、X为氧气、C为CO、E为二氧化碳、A为烃.
(2)B、X为单质,B能与X连续反应得到E,若E气体不是大气污染物,与水反应得到F是二元弱酸,则F为碳酸,B为碳、X为氧气、C为CO、E为二氧化碳、A为烃.
解答:
解:(1)B、X为单质,B能与X连续反应得到E,E气体是大气污染物,与水反应得到F是一元强酸,则F为HNO3,可推知,B为N2,C为NO,D为NO2,A与氧气反应得到D与NO,常温下D为无色液体,且A、B含同一种元素,故A为NH3、D为H2O,则:
①A为NH3,电子式为 ;非金属性O>N,故稳定性:NH3<H2O,
;非金属性O>N,故稳定性:NH3<H2O,
故答案为: ;<;
;<;
②反应①的化学方程式为:4NH3+5O2
4NO+6H2O,故答案为:4NH3+5O2
4NO+6H2O;
③反应③为:3NO2+H2O=2HNO3+NO,氧化剂与还原剂都是NO2,其氧化剂作用生成NO,其还原剂作用生成硝酸,氧化剂与还原剂的物质的量之比为1:2,故答案为:1:2;
④NO2气体通过盛有浓硫酸的洗气瓶,实验过程中,浓H2SO4中未发现有气体逸出,且浓H2SO4由无色变为红棕色,可说明NO2能溶于浓硫酸中,浓硫酸不能干燥NO2,
故答案为:NO2能溶于浓硫酸中,浓硫酸不能干燥NO2;
⑤a+b=14,说明氨水中c(OH-)与盐酸c(H+)相等,因一水合氨为弱电解质,如二者体积相等,氨水过量,溶液呈碱性,若反应后溶液的pH<7,则盐酸体积较大,故则V1<V2,故答案为:<;
(2)B、X为单质,B能与X连续反应得到E,若E气体不是大气污染物,与水反应得到F是二元弱酸,则F为碳酸,B为碳、X为氧气、C为CO、E为二氧化碳、A为烃,则:
①E为CO2,结构式为O=C=O,故答案为:O=C=O;
②KSP 只受温度的影响,温度不变,则KSP 不变,由KSP =c(Ba2+)×c(CO32-)=8.1×10-9可知,该沉淀放入0.1mol?L-1的BaCl2溶液中,c(Ba2+)=0.1mol?L-1,则c(CO32-)=8.1×10-8mol?L-1,故答案为:不变; 8.1×10-8.
①A为NH3,电子式为
 ;非金属性O>N,故稳定性:NH3<H2O,
;非金属性O>N,故稳定性:NH3<H2O,故答案为:
 ;<;
;<;②反应①的化学方程式为:4NH3+5O2
| ||
| △ |
| ||
| △ |
③反应③为:3NO2+H2O=2HNO3+NO,氧化剂与还原剂都是NO2,其氧化剂作用生成NO,其还原剂作用生成硝酸,氧化剂与还原剂的物质的量之比为1:2,故答案为:1:2;
④NO2气体通过盛有浓硫酸的洗气瓶,实验过程中,浓H2SO4中未发现有气体逸出,且浓H2SO4由无色变为红棕色,可说明NO2能溶于浓硫酸中,浓硫酸不能干燥NO2,
故答案为:NO2能溶于浓硫酸中,浓硫酸不能干燥NO2;
⑤a+b=14,说明氨水中c(OH-)与盐酸c(H+)相等,因一水合氨为弱电解质,如二者体积相等,氨水过量,溶液呈碱性,若反应后溶液的pH<7,则盐酸体积较大,故则V1<V2,故答案为:<;
(2)B、X为单质,B能与X连续反应得到E,若E气体不是大气污染物,与水反应得到F是二元弱酸,则F为碳酸,B为碳、X为氧气、C为CO、E为二氧化碳、A为烃,则:
①E为CO2,结构式为O=C=O,故答案为:O=C=O;
②KSP 只受温度的影响,温度不变,则KSP 不变,由KSP =c(Ba2+)×c(CO32-)=8.1×10-9可知,该沉淀放入0.1mol?L-1的BaCl2溶液中,c(Ba2+)=0.1mol?L-1,则c(CO32-)=8.1×10-8mol?L-1,故答案为:不变; 8.1×10-8.
点评:本题比较综合,涉及无机物推断、常用化学用语、氧化还原反应、溶液pH的有关计算、溶度积计算等,能正确推断物质是解本题关键,难度较大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
化学与人类生产、生活、社会可持续发展密切相关.下列有关说法正确的是( )
| A、高空臭氧层吸收太阳紫外线,保护地球生物;反应3O2═2O3有单质参加,属于氧化还原反应 |
| B、人造纤维,合成纤维和光导纤维都是有机高分子化合物 |
| C、大量燃烧化石燃料排放的废气中含大量CO2、SO2造成大气污染,从而使雨水pH=5.6形成酸雨 |
| D、加热能杀死流感病毒是因为病毒的蛋白质受热变性 |
关于下列实验装置的叙述中,正确的是( )
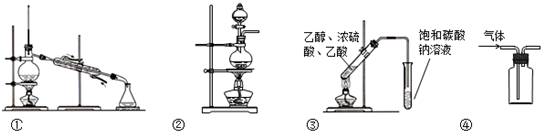

| A、装置①常用于分离互不相溶的液体 |
| B、装置②可用于实验室加热酒精与浓硫酸的混合物制取乙烯 |
| C、装置③可用于制备乙酸乙酯 |
| D、装置④可用于收集NO、CO2等气体 |
 前些天在北京、西安、南昌等25个大中城市都出现雾霾天气,人类的活动改变了全球的气候.全球气候变暖已经成为全世界人类面临的重大问题.
前些天在北京、西安、南昌等25个大中城市都出现雾霾天气,人类的活动改变了全球的气候.全球气候变暖已经成为全世界人类面临的重大问题.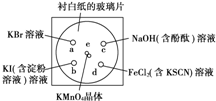 化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求.某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol?L-1的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,各种液滴彼此分开,围成半径小于表面皿的圆形(如图所示)在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即将表面皿盖好.
化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求.某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol?L-1的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,各种液滴彼此分开,围成半径小于表面皿的圆形(如图所示)在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即将表面皿盖好.