题目内容
设计出燃料电池使汽油氧化直接产生电流是本世纪最富有挑战性的课题之一.3年前有人制造了一种燃料电池,一个电极通入空气,另一电极通入汽油蒸气.电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-离子.回答如下问题:
(1)以丁烷代表汽油,这个电池放电时发生的化学反应的化学方程式是 .
(2)这个电池的负极发生的反应是 ;固体电解质里的O2-的移动方向是 .
(3)人们追求燃料电池氧化汽油而不在内燃机里燃烧汽油产生动力的主要原因是 .
(4)汽油燃料电池最大的障碍是氧化反应不完全产生 堵塞电极的气体通道.有人估计,完全避免这种副反应至少还需10年时间,正是新一代化学家的历史使命.
(5)你认为ZrO2晶体里掺杂Y2O3用Y3+代替晶体里部分Zr4+对提高固体电解质的导电能力起什么作用?其可能的原因是 .
(1)以丁烷代表汽油,这个电池放电时发生的化学反应的化学方程式是
(2)这个电池的负极发生的反应是
(3)人们追求燃料电池氧化汽油而不在内燃机里燃烧汽油产生动力的主要原因是
(4)汽油燃料电池最大的障碍是氧化反应不完全产生
(5)你认为ZrO2晶体里掺杂Y2O3用Y3+代替晶体里部分Zr4+对提高固体电解质的导电能力起什么作用?其可能的原因是
考点:化学电源新型电池
专题:电化学专题
分析:(1)燃料电池放电时发生的电池反应式和燃料燃烧反应方程式相同;
(2)燃料电池中,负极上燃料失电子发生氧化反应,正极上得电子发生还原反应,电解质溶液中阴离子向负极移动;
(3)原电池具有能量利用率高的特点;
(4)丁烷不完全氧化会生成碳粒,从而堵塞电极的气体通道.
(5)根据离子的移动分析.
(2)燃料电池中,负极上燃料失电子发生氧化反应,正极上得电子发生还原反应,电解质溶液中阴离子向负极移动;
(3)原电池具有能量利用率高的特点;
(4)丁烷不完全氧化会生成碳粒,从而堵塞电极的气体通道.
(5)根据离子的移动分析.
解答:
解:(1)燃料电池的总反应和燃料燃烧的化学方程式一致,电池总反应为2C4H10+13O2═8CO2+10H2O,
故答案为:2C4H10+13O2═8CO2+10H2O;
(2)燃料电池中,负极上燃料丁烷失电子发生氧化反应,即C4H10+13O2--26e-═4CO2+5H2O(或C4H10+26O2--52e-═8CO2+10H2O),电解质溶液中阴离子向负极移动,所以固体电解质里的O2-的移动方向是由正极流向负极,
故答案为:C4H10+13O2--26e-═4CO2+5H2O(或C4H10+26O2--52e-═8CO2+10H2O);由正极流向负极;
(3)原电池具有能量利用率高的特点,而燃烧时化学能转变为热能和光能,
故答案为:燃料电池具有较高的能量利用率;
(4)烷不完全氧化会生成碳粒,从而堵塞电极的气体通道,故答案为:碳粒.
(5)为维持电荷平衡,晶体中的O2-将减少,从而使O2-得以在电场作用下向负极移动,所以用Y3+代替晶体里的部分Zr4+对提高固体电解质的导电能力有帮助,
故答案为:为维持电荷平衡,晶体中的O2-将减少,从而使O2-得以在电场作用下向负极移动.
故答案为:2C4H10+13O2═8CO2+10H2O;
(2)燃料电池中,负极上燃料丁烷失电子发生氧化反应,即C4H10+13O2--26e-═4CO2+5H2O(或C4H10+26O2--52e-═8CO2+10H2O),电解质溶液中阴离子向负极移动,所以固体电解质里的O2-的移动方向是由正极流向负极,
故答案为:C4H10+13O2--26e-═4CO2+5H2O(或C4H10+26O2--52e-═8CO2+10H2O);由正极流向负极;
(3)原电池具有能量利用率高的特点,而燃烧时化学能转变为热能和光能,
故答案为:燃料电池具有较高的能量利用率;
(4)烷不完全氧化会生成碳粒,从而堵塞电极的气体通道,故答案为:碳粒.
(5)为维持电荷平衡,晶体中的O2-将减少,从而使O2-得以在电场作用下向负极移动,所以用Y3+代替晶体里的部分Zr4+对提高固体电解质的导电能力有帮助,
故答案为:为维持电荷平衡,晶体中的O2-将减少,从而使O2-得以在电场作用下向负极移动.
点评:本题考查了化学电源新型电池,明确原电池原理是解本题关键,难点是电极反应式的书写,难度中等.

练习册系列答案
相关题目
已知醋酸、醋酸根离子在溶液中存在下列平衡及其对应的平衡常数
CH3COOH?CH3COO-+H+ K1=1.75×10-5 △H1>0
CH3COO-+H2O+?CH3COOH+OH- K2=5.71×10-10 △H2>0
常温下,将等体积、等物质的量浓度的醋酸和醋酸钠溶液混合,下列叙述正确的是( )
CH3COOH?CH3COO-+H+ K1=1.75×10-5 △H1>0
CH3COO-+H2O+?CH3COOH+OH- K2=5.71×10-10 △H2>0
常温下,将等体积、等物质的量浓度的醋酸和醋酸钠溶液混合,下列叙述正确的是( )
| A、混合溶液PH<7 |
| B、对混合溶液进行微热,K1增大、K2减小 |
| C、调节混合溶液的PH值至中性,则此时溶液中c(Na+)═c(CH3COO-) |
| D、温度不变,若在混合溶液中加入少量NaOH固体,c(CH3COO-)减小 |
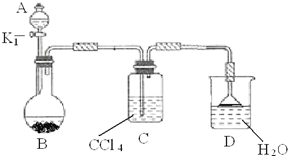 以下为苯的取代反应的探究实验.
以下为苯的取代反应的探究实验.
 .
.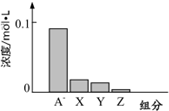 常温下,0.2mol/L 的一元酸 HA 与等浓度的 NaOH 溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示.请回答下列问题:
常温下,0.2mol/L 的一元酸 HA 与等浓度的 NaOH 溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示.请回答下列问题: 结构基团,同时符合上述要求的所有同分异构体共有(不考虑立体异构)( )
结构基团,同时符合上述要求的所有同分异构体共有(不考虑立体异构)( )