题目内容
7.设NA为阿伏伽德罗常数的值,下列叙述正确的是( )| A. | 加热条件下,1 mol Cl2与足量铁粉充分反应,转移的电子数为3NA | |
| B. | 1 L 1 mol/L的Na2CO3溶液中所含Na+ 离子数为NA | |
| C. | 标准状况下,11.2 L H2O中含有的电子数为5NA | |
| D. | 1 mol CO2和O2的混合气体中所含氧原子数为2NA |
分析 A.1mol氯气与铁粉完全反应最多得到2mol电子;
B.根据n=cV计算出碳酸钠的物质的量,然后计算出钠离子的物质的量及数目;
C.标准状况下,水的状态不是气态;
D.二氧化碳和氧气分子中都含有2个氧原子,1mol混合物中含有2mol氧原子.
解答 解:A.加热条件下,1mol氯气与足量铁粉反应最多得到2mol电子,转移的电子数为2NA,故A错误;
B.1 L 1 mol/L的Na2CO3溶液中含有碳酸钠的物质的量为1mol,1mol碳酸钠中含有2mol钠离子,所含Na+ 离子数为2NA,故B错误;
C.标准状况下,水的状态不是气体,不能使用标准状况下得到气体摩尔体积计算11.2 L H2O的物质的量,故C错误;
D.1 mol CO2和O2的混合气体中含有2mol氧原子,所含氧原子数为2NA,故D正确;
故选D.
点评 本题考查了物质的量的计算,题目难度中等,明确物质的量与摩尔质量、物质的量浓度、阿伏伽德罗常数之间的关系为解答关键,C为易错点,注意标准状况下气体摩尔体积的使用条件,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
17.25℃时,0.1mol/L下列溶液的pH如表,有关比较正确的是( )
| 序号 | ① | ② | ③ | ④ | ⑤ |
| 溶液 | NaCl | CH3COONH4 | NaClO | NaHCO3 | Na2CO3 |
| pH | 7.0 | 7.0 | 10.3 | 8.3 | 11.6 |
| A. | 酸性的相对强弱:HClO<HCO3- | |
| B. | 由水电离产生的c(H+):①=② | |
| C. | 溶液③④中酸根离子浓度:c(ClO-)>c(HCO3-) | |
| D. | 在④⑤溶液等体积混合后的溶液中:c(HCO3-)+c(CO32-)+c(H2CO3)=0.1 mol/L |
18.化学中有许多的“守恒或相等”.下列说法不正确的是( )
| A. | 溶液中,稀释前溶质质量与稀释后溶质质量 | |
| B. | 溶液中,阳离子电荷总数与阴离子电荷总数 | |
| C. | 化学反应中,反应物总能量与生成物总能量 | |
| D. | 化学反应中,参加反应物总质量与生成物总质量 |
15.下列反应中,S元素的化合价升高的是( )
| A. | Zn+H2SO4═ZnSO4+H2↑ | |
| B. | C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O | |
| C. | H2S+CuSO4═CuS↓+H2SO4 | |
| D. | S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2 |
12.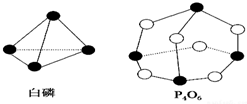 化学键的键能是形成(或断开)1mol化学键时释放(或吸收)的能量.已知白磷和P4O6的分子结构如下图所示,现提供以下化学键的键能(kJ/mol):P-P:198,P-O:360,O=O:498,若生成1mol P4O6,则反应P4(白磷)+3O2=P4O6中的能量变化为( )
化学键的键能是形成(或断开)1mol化学键时释放(或吸收)的能量.已知白磷和P4O6的分子结构如下图所示,现提供以下化学键的键能(kJ/mol):P-P:198,P-O:360,O=O:498,若生成1mol P4O6,则反应P4(白磷)+3O2=P4O6中的能量变化为( )
 化学键的键能是形成(或断开)1mol化学键时释放(或吸收)的能量.已知白磷和P4O6的分子结构如下图所示,现提供以下化学键的键能(kJ/mol):P-P:198,P-O:360,O=O:498,若生成1mol P4O6,则反应P4(白磷)+3O2=P4O6中的能量变化为( )
化学键的键能是形成(或断开)1mol化学键时释放(或吸收)的能量.已知白磷和P4O6的分子结构如下图所示,现提供以下化学键的键能(kJ/mol):P-P:198,P-O:360,O=O:498,若生成1mol P4O6,则反应P4(白磷)+3O2=P4O6中的能量变化为( )| A. | 吸收1638kJ能量 | B. | 放出1638kJ能量 | C. | 吸收126kJ能量 | D. | 放出126kJ能量 |
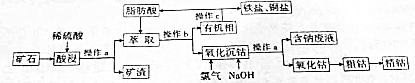
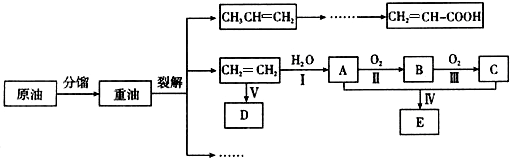
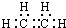 .
.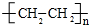 .
.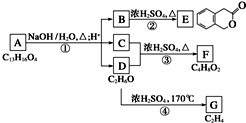 图中A、B、C、D、E、F、G均为有机化合物.根据下图回答问题.
图中A、B、C、D、E、F、G均为有机化合物.根据下图回答问题. .反应①的反应类型是水解反应(取代反应).
.反应①的反应类型是水解反应(取代反应).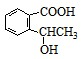 、
、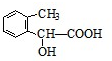 、
、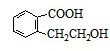 .
.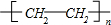 或CH2=CH2+H2O$→_{△}^{催化剂}$CH3CH2OH.
或CH2=CH2+H2O$→_{△}^{催化剂}$CH3CH2OH.