题目内容
18.化学中有许多的“守恒或相等”.下列说法不正确的是( )| A. | 溶液中,稀释前溶质质量与稀释后溶质质量 | |
| B. | 溶液中,阳离子电荷总数与阴离子电荷总数 | |
| C. | 化学反应中,反应物总能量与生成物总能量 | |
| D. | 化学反应中,参加反应物总质量与生成物总质量 |
分析 A.溶液在稀释过程中溶质的总质量不变;
B.溶液中一定满足电荷守恒;
C.化学反应中伴随着能量变化,则反应物与生成物总能量不相等;
D.化学反应中遵循质量守恒定律.
解答 解:A.溶液在稀释过程中溶质的总质量不变,则稀释前溶质质量与稀释后溶质质量,故A正确;
B.溶液中遵循电荷守恒,则阳离子电荷总数与阴离子电荷总数,故B正确;
C.化学反应中的能量变化与反应物、生成物总能量大小有关,任何化学反应都伴随着能量变化,则反应物与生成物总能量一定不相等,故C错误;
D.化学反应为原子之间的重新组合,原子种类没有不变,则化学反应遵循质量守恒定律,故D正确;
故选C.
点评 本题考查了化学反应中的守恒关系及应用,题目难度不大,明确质量守恒定律、电荷守恒、溶液稀释定律的内容为解答关键,试题侧重基础知识的考查,培养了学生的灵活应用能力.

练习册系列答案
相关题目
8.X、Y、Z、M、W为五种短周期元素,X、Y、Z是原子序数递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子,Y与M形成的气态化合物在标准状况下的密度为0.76g.L-1,W的质子数是X、Y、Z、M四种元素质子之和的$\frac{1}{2}$,下列说法正确的是( )
| A. | 原子半径:X>Y>Z>M | |
| B. | 1molW溶于足量水中完全反应其转移2mol电子 | |
| C. | YZ2溶于水形成的溶液具有较强的氧化性 | |
| D. | 由X、Y、Z、M四种元素形成的化合物一定只有离子键 |
6.下列说法正确的是( )
| A. | 纯水的pH值一定等于7 | |
| B. | [H+]大于10-7mol/L的溶液一定是酸性溶液 | |
| C. | pH=2的溶液中[H+]是pH=1的溶液的两倍 | |
| D. | [H+]=2×10-7mol/L的溶液可能是中性溶液 |
13.具有显著抗癌活性的10-羟基喜树碱的结构如图所示.下列关于10-羟基喜树碱的说法不正确的是( )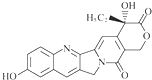

| A. | 可以与溴水反应 | |
| B. | 可以与FeCl3溶液发生显色反应 | |
| C. | 可以与浓HBr溶液反应 | |
| D. | 一定条件下,1 mol该物质最多可与1 mol NaOH反应 |
3.关于有机物的说法正确的是( )
| A. | 甲烷是一种很清洁的能源,它是液化石油气和天然气的主要成分 | |
| B. | 用高锰酸钾浸泡过的砖块可使水果保鲜,是利用了乙烯的还原性 | |
| C. | 苯不能使酸性高锰酸钾溶液褪色,说明它是一种饱和烃,很稳定 | |
| D. | 交警用重铬酸钾检查司机是否酒后驾车,是利用了乙醇的氧化性 |
7.设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 加热条件下,1 mol Cl2与足量铁粉充分反应,转移的电子数为3NA | |
| B. | 1 L 1 mol/L的Na2CO3溶液中所含Na+ 离子数为NA | |
| C. | 标准状况下,11.2 L H2O中含有的电子数为5NA | |
| D. | 1 mol CO2和O2的混合气体中所含氧原子数为2NA |

 +
+ $\stackrel{△}{→}$
$\stackrel{△}{→}$
 $\stackrel{KMnO_{4}/H+}{→}$
$\stackrel{KMnO_{4}/H+}{→}$ +
+
 ;理论上B也可以由1,3-丁二烯与烃F来合成,则F的名称(系统命名法):2-丁炔;C中含有的官能团的名称是羰基和羧基.
;理论上B也可以由1,3-丁二烯与烃F来合成,则F的名称(系统命名法):2-丁炔;C中含有的官能团的名称是羰基和羧基. ;它与E不互为(填“互为”或“不互为”)同分异构体.
;它与E不互为(填“互为”或“不互为”)同分异构体.