题目内容
2.金属钴抗腐蚀性强,可用于生产不锈钢.以含钴矿石(主要成份为CoO,还有少量SiO2、Fe2O3和CuO等)为原料生产钻的工艺流程如图所示(已知钴的主要化合价为+2、+3):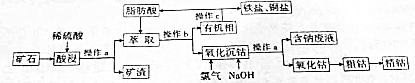
(1)酸浸前通常要将矿石份碎,则粉粹的目的是加快酸浸速率.
(2)若在实验中进行操作a、操作b,则实验中均需要用到的一种玻璃仪器是烧杯,操作c中得到盐与脂肪酸,则操作c的名称是蒸馏.
(3)由流程图中的信息,可得出铁、铜、钴的硫酸盐的溶解性的差异是铁、铜的硫酸盐易溶于有机溶剂脂肪酸,而钴的硫酸盐难溶于有机溶剂脂肪酸.
(4)“氧化沉钴”时发生反应的离子方程式为2Co2++Cl2+4OH-=Co2O3+2Cl-+2H2O.
(5)氧化钴→粗钴的化学方程式为Co2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Co+3CO2;若用电解法获得精钴,阳极材料是粗钴.
(6)锂离子电池是一种二次电池,它主要依靠锂离子在正极(嵌入有Li的CoO2)和负极(嵌入有Li的C6)之间的移动来工作.在充、放电过程中,Li+在两个电极之间往返嵌入和脱嵌.已知充电时电池的阴极反应为6C+xLi++xe-═LixC6,则放电时电池的正极反应式为CoO2+e-+Li+=LiCoO2,放电过程中Li+向正(填“正”或“负”)极移动.
分析 含钴矿石(主要成份为CoO,还有少量SiO2、Fe2O3和CuO等)用稀硫酸酸浸,过滤后除去滤渣,将滤液进行萃取,经过分液操作后得到有机相和无机相,将无机相中加入氯气和氢氧化钠进行氧化沉钴,过滤后得含钠的滤液和氧化钴固体,将氧化钴固体用一氧化碳还原得粗钴,再用电解法可获得精钴,将有机相进行蒸馏得到铁盐、铜盐和脂肪酸,脂肪酸再用于前面的萃取,进行循环利用,
(1)将矿石份碎,可以增大与酸的接触面积,进而可以加快反应速率;
(2)根据上面的分析可知,操作a为过滤,操作b为分液,根据实验中所用玻璃仪器判断;操作c为分离两种互溶液的液体,据此确定操作名称;
(3)根据流程图中的信息可知,铁、铜的硫酸盐易溶于有机溶剂,而钴的硫酸盐难溶于有机溶剂;
(4)“氧化沉钴”时,氯气在碱性条件下将+2价钴离子氧化成三氧化二钴,根据电荷守恒和元素守恒书写离子方程式;
(5)用CO还原氧化钴可得粗钴;根据电解精炼的原理可知,用电解法获得精钴,阳极材料是粗钴;
(6)充电时电池的阴极反应为6C+xLi++xe-═LixC6,则放电时的负极反应为LixC6-xe-═6C+xLi+,所以根据锂离子电池的工作原理,放电时电池的正极发生还原反应,即锂离子得电子生成锂,在原电池中,阳离子向正极运动,阴离子向负极运动,据此答题.
解答 解:含钴矿石(主要成份为CoO,还有少量SiO2、Fe2O3和CuO等)用稀硫酸酸浸,过滤后除去滤渣,将滤液进行萃取,经过分液操作后得到有机相和无机相,将无机相中加入氯气和氢氧化钠进行氧化沉钴,过滤后得含钠的滤液和氧化钴固体,将氧化钴固体用一氧化碳还原得粗钴,再用电解法可获得精钴,将有机相进行蒸馏得到铁盐、铜盐和脂肪酸,脂肪酸再用于前面的萃取,进行循环利用,
(1)将矿石份碎,可以增大与酸的接触面积,进而可以加快反应速率,所以粉粹的目的是加快酸浸速率,
故答案为:加快酸浸速率;
(2)根据上面的分析可知,操作a为过滤,操作b为分液,根据实验中所用玻璃仪器可知,都要用到烧杯,操作c为分离两种互溶液的液体,可以用蒸馏,
故答案为:烧杯;蒸馏;
(3)根据流程图中的信息可知,铁、铜的硫酸盐易溶于有机溶剂,而钴的硫酸盐难溶于有机溶剂,
故答案为:铁、铜的硫酸盐易溶于有机溶剂脂肪酸,而钴的硫酸盐难溶于有机溶剂脂肪酸;
(4)“氧化沉钴”时,氯气在碱性条件下将+2价钴离子氧化成三氧化二钴,反应的离子方程式为2Co2++Cl2+4OH-=Co2O3+2Cl-+2H2O,
故答案为:2Co2++Cl2+4OH-=Co2O3+2Cl-+2H2O;
(5)用CO还原氧化钴可得粗钴,反应的化学方程式为Co2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Co+3CO2,根据电解精炼的原理可知,用电解法获得精钴,阳极材料是粗钴,
故答案为:Co2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Co+3CO2;粗钴;
(6)充电时电池的阴极反应为6C+xLi++xe-═LixC6,则放电时的负极反应为LixC6-xe-═6C+xLi+,所以根据锂离子电池的工作原理,放电时电池的正极发生还原反应,即CoO2得电子,电极反应式为CoO2+e-+Li+=LiCoO2,在原电池中,阳离子向正极运动,阴离子向负极运动,
故答案为:CoO2+e-+Li+=LiCoO2;正.
点评 本题为生产流程题,涉及金属的回收、环境保护、氧化还原反应、物质的分离提纯和除杂等问题,题目较为综合,做题时注意仔细审题,从题目中获取关键信息,难度中等,难点是电极反应式的书写.

 全优点练单元计划系列答案
全优点练单元计划系列答案
| A. | 可以与溴水反应 | |
| B. | 可以与FeCl3溶液发生显色反应 | |
| C. | 可以与浓HBr溶液反应 | |
| D. | 一定条件下,1 mol该物质最多可与1 mol NaOH反应 |
| A. | 向氯化铝溶液中滴加过量的氨水:4NH3•H2O+Al3+═AlO2-+4NH4++2H2O | |
| B. | NH4Al(SO4)2溶液中滴加少量NaOH溶液:Al3++NH4++4OH-=Al(OH)3↓+NH3•H2O | |
| C. | 向明矾溶液中加入过量的Ba(OH)2溶液:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O | |
| D. | 向NaAlO2溶液中通入足量CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
| A. | 加热条件下,1 mol Cl2与足量铁粉充分反应,转移的电子数为3NA | |
| B. | 1 L 1 mol/L的Na2CO3溶液中所含Na+ 离子数为NA | |
| C. | 标准状况下,11.2 L H2O中含有的电子数为5NA | |
| D. | 1 mol CO2和O2的混合气体中所含氧原子数为2NA |
| A. | C2H6 | B. | C2H4 | C. | C3H8 | D. | C3H6 |
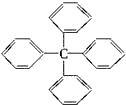
| A. | 此物质分子式为C25H18,属于苯的同系物 | |
| B. | 其一氯代物共有四种 | |
| C. | 此分子最多有13个碳原子在一个平面上 | |
| D. | 该物质能使溴水因化学反应而褪色 |
 和
和 ;
; 和
和 ;
;