题目内容
A、B、C、D是短周期的四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,能生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和.试回答:
(1)A原子的电子式为 ,B元素能形成的两种同素异形体的物质的化学式为 ,C元素的离子结构示意图为 .
(2)化合物E中所含有的化学键是 ,它属于 化合物.
(3)写出A、B两元素形成的化合物与E反应的化学方程式: .
(4)写出D的最高价氧化物的水化物和A单质反应的化学方程式: .此反应中氧化产物与还原产物的物质的量之比为 .
(1)A原子的电子式为
(2)化合物E中所含有的化学键是
(3)写出A、B两元素形成的化合物与E反应的化学方程式:
(4)写出D的最高价氧化物的水化物和A单质反应的化学方程式:
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D为四种短周期元素,原子序数依次增大,B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,则固体E为Na2O2,则B为O元素、C为Na元素;A的原子序数小于B,且A原子的最外层上有4个电子,则A为C元素;D的L层电子数等于K、M两个电子层上电子数之和,则D原子M层电子数为8-2=6,核外各层电子分别为2、8、6,则D为S元素,据此解答.
解答:
解:A、B、C、D为四种短周期元素,原子序数依次增大,B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,则固体E为Na2O2,则B为O元素、C为Na元素;A的原子序数小于B,且A原子的最外层上有4个电子,则A为C元素;D的L层电子数等于K、M两个电子层上电子数之和,则D原子M层电子数为8-2=6,核外各层电子分别为2、8、6,则D为S元素,
(1)A为C元素,原子的电子式为 ,B为O元素,形成的两种同素异形体的化学式为O2、O3,C为Na元素,其离子结构示意图为:
,B为O元素,形成的两种同素异形体的化学式为O2、O3,C为Na元素,其离子结构示意图为: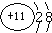 ,
,
故答案为: ;O2、O3;
;O2、O3;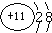 ;
;
(2)化合物E为Na2O2,含有离子键、共价键,属于离子化合物,
故答案为:离子键、共价键;离子;
(3)二氧化碳与过氧化钠反应生成碳酸钠与氧气,化学反应方程式为:2Na2O2+CO2=2Na2CO3+O2,
故答案为:2Na2O2+CO2=2Na2CO3+O2;
(4)碳与浓硫酸在加热条件下反应生成二氧化碳、二氧化硫与水,反应方程式为:C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O,反应中二氧化碳为氧化产物,二氧化硫为还原产物,故反应中氧化产物与还原产物的物质的量之比为1:2,
故答案为:C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O;1:2.
(1)A为C元素,原子的电子式为
 ,B为O元素,形成的两种同素异形体的化学式为O2、O3,C为Na元素,其离子结构示意图为:
,B为O元素,形成的两种同素异形体的化学式为O2、O3,C为Na元素,其离子结构示意图为: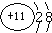 ,
,故答案为:
 ;O2、O3;
;O2、O3;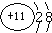 ;
;(2)化合物E为Na2O2,含有离子键、共价键,属于离子化合物,
故答案为:离子键、共价键;离子;
(3)二氧化碳与过氧化钠反应生成碳酸钠与氧气,化学反应方程式为:2Na2O2+CO2=2Na2CO3+O2,
故答案为:2Na2O2+CO2=2Na2CO3+O2;
(4)碳与浓硫酸在加热条件下反应生成二氧化碳、二氧化硫与水,反应方程式为:C+2H2SO4(浓)
| ||
故答案为:C+2H2SO4(浓)
| ||
点评:本题考查结构性质位置关系应用,侧重对化学用语的考查,比较基础,注意对基础知识的积累掌握.

练习册系列答案
相关题目
下列做法可改善大气质量的是( )
| A、回收废旧电池 |
| B、使用无磷洗衣粉 |
| C、开发燃料电池汽车,消除机动车尾气污染 |
| D、加高工厂的烟囱,使烟尘和废气远离地表 |
根据化学反应的实质是旧键断裂和新键形成的过程,下列变化中不属于化学变化的是( )
| A、白磷在260℃转化成红磷 |
| B、石墨在高温高压下转化为金刚石 |
| C、干冰转变为CO2气体 |
| D、固态S8加热到444.6℃时变成硫蒸气S2 |
当溶液中HS-+H2O?S2-+H3O+达到平衡时,欲使C(S2-)增大,应加入( )
| A、CuSO4 |
| B、Na2CO3 |
| C、H2O |
| D、HCl |

 如图所示的装置,C、D、E、F均为惰性电极.将电源接通后,向乙中滴入酚酞溶液,在F极附近显红色.试回答下列问题:(1)电极A是
如图所示的装置,C、D、E、F均为惰性电极.将电源接通后,向乙中滴入酚酞溶液,在F极附近显红色.试回答下列问题:(1)电极A是