题目内容
18.设NA为阿伏伽德罗常数的值,下列叙述正确的是( )| A. | 7.8gNa2S和Na2O2的混合物中含有的阴离子数目大于0.1NA,小于0.2NA | |
| B. | 常温下0.1mol•L-1的NH4NO3溶液中氮原子数为0.2NA | |
| C. | 标准状况下,2.24L CHCl3的分子数为0.1NA | |
| D. | 19gT35Cl和H37Cl的混合物中所含中子数为10NA |
分析 A.Na2S和Na2O2的摩尔质量均为78g/mol,两种化合物的阳离子与阴离子个数比均为2:1;
B.溶液体积不知不能计算微粒数;
C.标准状况下三氯甲烷不是气体;
D.T35Cl和H37Cl的摩尔质量为38g/mol,质量数=质子数+中子数计算分析.
解答 解:A.Na2S和Na2O2的摩尔质量均为78g/mol,则混合物的总物质的量为 $\frac{7.8g}{78g/mol}$=0.1mol,两种化合物的阳离子与阴离子个数比均为2:1,因此所含有的阴离子的个数为0.1mol×NAmol-1×1=0.1NA,故A错误;
B.溶液体积不知,不能计算氮原子数目,故B错误;
C.标准状况下三氯甲烷不是气体,2.24L CHCl3的物质的量不是0.1mol,故C错误;
D.19gT35Cl和H37Cl的混合物物质的量=$\frac{19g}{38g/mol}$=0.5mol,T35Cl和H37Cl的中子数3-1+35-17=20,1-1+37-17=20,都为20,19gT35Cl和H37Cl的混合物物质的量为0.5mol其中所含中子数为10NA,故D正确.
故选D.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意熟练掌握以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确标况下气体摩尔体积的使用条件及标况下常见物质的状态,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系,试题有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案
相关题目
11.下列做法与可持续发展宗旨相违背的是( )
| A. | 改善能源结构,大力发展太阳能、风能等清洁能源 | |
| B. | 推广碳捕集和储存技术,逐步实现二氧化碳零排放 | |
| C. | 推广使用煤液化、气化技术,减少二氧化碳的排放 | |
| D. | 工业废水、生活污水净化处理,减少污染物的排放 |
6.下列关于化学平衡的说法中,正确的是( )
| A. | 当达到化学平衡时,反应物已完全转化为生成物 | |
| B. | 化学平衡是一定条件下的平衡,当条件改变时,平衡可能会遭到破坏 | |
| C. | 当达到化学平衡时,反应混合物中各成分的浓度相等 | |
| D. | 当达到化学平衡时,正逆反应均已停止 |
13.下列有机物命名正确的是( )
| A. |  (2-乙基丙烷) (2-乙基丙烷) | B. | CH3CH2CH2CH2OH(1-丁醇) | ||
| C. |  (间二甲苯) (间二甲苯) | D. | CH3C(CH3)=CH2(2-甲基-2-丙烯) |
10.钛铁矿的主要成分为FeTiO3(可表示为FeO•TiO2).用浓盐酸溶解钛铁矿去渣得溶液(含有Fe2+、TiOCl42-等),调节溶液的pH并加热,过滤的TiO2和滤液.控制反应温度在95℃左右,向滤液中加入H2O2和NH4H2PO4得到FePO4.再将FePO4与Li2CO3和H2C2O4一起煅烧,可制取LiFePO4.有关数据如下表所示:
(1)FeTiO3中Ti的化合价为+4,盐酸与FeTiO3反应的离子方程式为FeTiO3+4H++4Cl-=Fe2++TiOCl42-+2H2O.检验溶液中Fe2+的方法是先滴加KSCN溶液,不显血红色,再加入过氧化氢,溶液显血红色.
(2)为提供FePO4的产率,根据上述制备方法和表中数据,应采取的正确措施是d(填正确答案的标号).
a.不加H2O2 b.调节溶液pH至5 c.降低反应温度 d.增大NH4H2PO4的用量
(3)磷的含氧酸H3PO2与足量的NaOH溶液反应,生成NaH2PO2.则H3PO2为一元酸;在LiFePO4中的化学键有离子键、共价键,在制备LiFePO4的过程中加入H2C2O4的作用是还原FePO4.
(4)LiFePO4可作锂电池的电极材料.充电时,Li+从LiFePO4晶格中迁移出来,部分LiFePO4转化为Li1-xFePO4,则阳极的电极反应式为LiFePO4-xe-═Li1-xFePO4+xLi+.
(5)电化学还原TiO2是获取金属钛的常用方法.采用熔融盐作电解质,用石墨作阳极,总反应为TiO2$\frac{\underline{\;电解\;}}{\;}$Ti+O2↑
①电解过程中,阳极不断被消耗而需要定期更换,其原因是2O2--4e-═O2↑,C+O2=CO2(用反应式表示).
②电解由含80%FeTiO3的钛铁矿制取的TiO2得到12kg金属钛,已知电流效率为76%,则至少需要该种钛铁矿62.5kg.(电流效率=$\frac{实际产量}{理论产量}$×100%)
| 化合物 | Fe(OH)2 | Fe(OH)3 | FePO4 | Fe3(PO4)2 |
| Ksp近似值 | 10-17 | 10-38 | 10-22 | 10-36 |
(2)为提供FePO4的产率,根据上述制备方法和表中数据,应采取的正确措施是d(填正确答案的标号).
a.不加H2O2 b.调节溶液pH至5 c.降低反应温度 d.增大NH4H2PO4的用量
(3)磷的含氧酸H3PO2与足量的NaOH溶液反应,生成NaH2PO2.则H3PO2为一元酸;在LiFePO4中的化学键有离子键、共价键,在制备LiFePO4的过程中加入H2C2O4的作用是还原FePO4.
(4)LiFePO4可作锂电池的电极材料.充电时,Li+从LiFePO4晶格中迁移出来,部分LiFePO4转化为Li1-xFePO4,则阳极的电极反应式为LiFePO4-xe-═Li1-xFePO4+xLi+.
(5)电化学还原TiO2是获取金属钛的常用方法.采用熔融盐作电解质,用石墨作阳极,总反应为TiO2$\frac{\underline{\;电解\;}}{\;}$Ti+O2↑
①电解过程中,阳极不断被消耗而需要定期更换,其原因是2O2--4e-═O2↑,C+O2=CO2(用反应式表示).
②电解由含80%FeTiO3的钛铁矿制取的TiO2得到12kg金属钛,已知电流效率为76%,则至少需要该种钛铁矿62.5kg.(电流效率=$\frac{实际产量}{理论产量}$×100%)
7.向0.1mol/L的NH4HCO3溶液中逐滴加入0.1mol/LNaOH溶液时,含氮、含碳粒子的分布情况如图所示(纵坐标是各粒子的分布系数,即物质的量分数).根据图象,下列说法不正确的是( )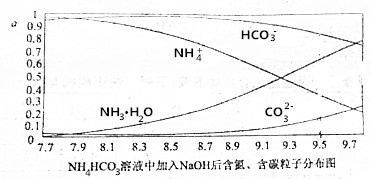

| A. | 开始阶段,HCO3-反而略有增加,可能是因为NH4HCO3溶液中存在H2CO3发生的主要反应是H2CO3+OH-═HCO3-+H2O | |
| B. | 当pH大于8.7以后,碳酸氢根离子和铵根离子同时与氢氧根离子反应 | |
| C. | pH=9.5时,溶液中c(HCO3-)>c(HN3•H2O)>c(NH4+)>c(CO32-) | |
| D. | 滴加氢氧化钠溶液时,首先发生的反应为2NH4HCO3+2NaOH═(NH4)2CO3+Na2CO3 |

 ;②
;②
 )、羧基和醚键.(填名称)
)、羧基和醚键.(填名称) ;D→E的反应类型是氧化反应.
;D→E的反应类型是氧化反应. 等.
等. )的合成路线流程图(无机试剂可任选)).合成路线流程图示例如下:
)的合成路线流程图(无机试剂可任选)).合成路线流程图示例如下: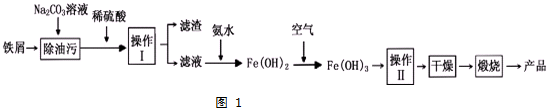
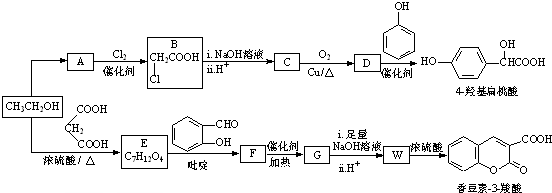
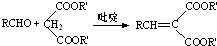 (R,R′,R″表示氢、烷基或芳基)
(R,R′,R″表示氢、烷基或芳基)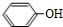 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$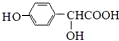 .
.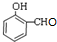 $\stackrel{吡啶}{→}$
$\stackrel{吡啶}{→}$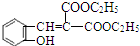 +H2O.
+H2O.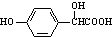 )的同分异构体
)的同分异构体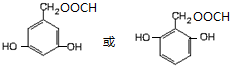 .
.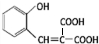 $\stackrel{浓硫酸}{→}$
$\stackrel{浓硫酸}{→}$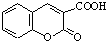 +H2O.
+H2O.