题目内容
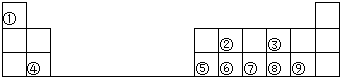
16.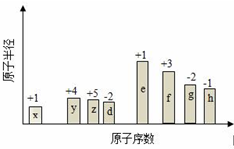 随原子序数的递增,八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如图所示.
随原子序数的递增,八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如图所示.根据判断出的元素回答问题:
(1)d在元素周期表的位置是第二周期ⅥA族.
(2)d、e、f常见简单离子的半径由大到小为r(O2-)>r(Na+)>r(Al3+)(用化学式表示,下同);y、f、g、h的最高价氧化物对应的水化物的酸性由强到弱是:HClO4>H2SO4>H2 CO3>Al(OH)3.
(3)用电子式表示由x和g两种元素形成的化合物的形成过程
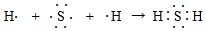 .
.(4)由x、y、d三种元素形成的相对分子质量最小的化合物可作为燃料电池的燃料,以KOH溶液为电解质溶液,写出负极反应式为CH2O-4e-+6OH-=CO32-+4 H2O.
分析 从图中的化合价、原子半径的大小及原子序数,可知x是H元素,y是C元素,z是N元素,d是O元素,e是Na元素,f是Al元素,g是S元素,h是Cl元素.
(1)主族元素周期数=电子层数、主族族序数=最外层电子数;
(2)电子层结构相同的离子,核电荷数越大离子半径越小;非金属性越强,最高价氧化物水化物的酸性越强;
(3)x与g形成的化合物为H2S,属于共价化合物;
(4)由x、y、d三种元素形成的相对分子质量最小的化合物为HCHO,原电池负极发生氧化反应,甲醛在负极失去电子,碱性条件下生成碳酸根离子与水.
解答 解:从图中的化合价、原子半径的大小及原子序数,可知x是H元素,y是C元素,z是N元素,d是O元素,e是Na元素,f是Al元素,g是S元素,h是Cl元素.
(1)d是O元素,原子核外有2个电子层,最外层电子数为6,在元素周期表的位置是第二周期ⅥA族,
故答案为:第二周期ⅥA族;
(2)电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:r(O2-)>r(Na+)>r(Al3+),
非金属性越强,最高价氧化物水化物的酸性越强,故酸性:HClO4>H2SO4>H2 CO3>Al(OH)3,
故答案为:r(O2-)>r(Na+)>r(Al3+);HClO4>H2SO4>H2 CO3>Al(OH)3;
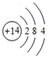
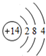
(3)x与g形成的化合物为H2S,属于共价化合物,用电子式表示形成过程为: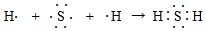 ,
,
故答案为: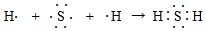 ;
;
(4)由x、y、d三种元素形成的相对分子质量最小的化合物为HCHO,原电池负极发生氧化反应,甲醛在负极失去电子,碱性条件下生成碳酸根离子与水,负极电极反应式为:CH2O-4e-+6OH-=CO32-+4 H2O,
故答案为:CH2O-4e-+6OH-=CO32-+4 H2O.
点评 本题考查结构位置性质关系、离子半径的大小比较、元素周期律、电子式、原电池等,是对学生综合能力的考查,需要学生具备扎实的基础,难度中等.

| A. | CO32-+H2O HCO3-+OH-; 用热的纯碱溶液清洗油污 | |
| B. | SnCl2+H2OSn( OH)Cl+HCl;配制氯化亚锡溶液时加入氢氧化钠溶液 | |
| C. | A13++3HCO3-=Al (OH)3↓+3CO2↑;泡沫灭火器灭火 | |
| D. | A13++3H2OAl (OH)3(胶体)+3H+;明矾净水 |
| A. | 1 L 该溶液中含硝酸钾 202 g | |
| B. | 100 mL 该溶液中含硝酸钾 0.02 mol | |
| C. | 从 1 L 该溶液中取出 500 mL 后,剩余溶液的浓度为 0.1 mol/L | |
| D. | 1 L 水中溶解 0.2 mol 硝酸钾,即可配得 0.2 mol/L 硝酸钾溶液 |
| A. | Al3+、Ag+、NO3-、SO42- | B. | Mg2+、NH4+、NO3-、Cl- | ||
| C. | Cu2+、Cl-、NO3-、Cl- | D. | K+、Na+、ClO-、S2- |
| A. | 冰箱内放置木炭除异味 | |
| B. | 炒菜时油锅着火,立即盖上锅盖 | |
| C. | 用食醋除去水壶中的水垢 | |
| D. | 用燃着的木条检查液化石油气的泄漏 |


 .
.
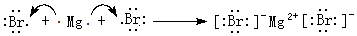 .
.