题目内容
4.下列关于 0.2mol/L 硝酸钾溶液的叙述中,正确的是( )| A. | 1 L 该溶液中含硝酸钾 202 g | |
| B. | 100 mL 该溶液中含硝酸钾 0.02 mol | |
| C. | 从 1 L 该溶液中取出 500 mL 后,剩余溶液的浓度为 0.1 mol/L | |
| D. | 1 L 水中溶解 0.2 mol 硝酸钾,即可配得 0.2 mol/L 硝酸钾溶液 |
分析 A、依据n=CV=$\frac{m}{M}$计算;
B、依据溶质物质的量n=CV计算得到;
C、溶液时均一稳定的分散系,溶质浓度与溶液体积无关;
D、1L水中溶解0.2mol硝酸钾,得到溶液体积大于1L.
解答 解:A、1L 0.2mol/L硝酸钾溶液中溶质硝酸钾质量=1L×0.2mol/L×101g/mol=20.2g,故A错误;
B、100mL0.2mol/L硝酸钾溶液中含硝酸钾物质的量=0.1L×0.2mol/L=0.02mol,故B正确;
C、溶液时均一稳定的分散系,溶质浓度与溶液体积无关,从1L该溶液中取出500mL后,剩余溶液的浓度为0.2mol/L,故C错误;
D、1L水中溶解0.2mol硝酸钾,得到溶液体积大于1L,配得硝酸钾溶液浓度小于0.2mol/L,故D错误;
故选B.
点评 本题考查了溶液中溶质物质的量、物质的量浓度计算分析判断,掌握概念实质是关键,题目较简单.

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
14.已知只有质子数或中子数为奇数的原子核有核磁共振(NMR)现象,试判断下列哪组原子均可产生NMR现象( )
| A. | 18O 31P 35Cl | B. | 27Al 19F 12C | ||
| C. | 第一周期所有元素的原子 | D. | 元素周期表中ⅤA所有元素的原子 |
15.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | pH=1的溶液中:Na+、K+、MnO4-、CO32- | |
| B. | c(H+)=1×10-13mol•L-1的溶液中:Mg2+、Cu2+、SO42-、NO3- | |
| C. | 0.1 mol•L-1 NH4HCO3溶液中:K+、Na+、NO3-、Cl- | |
| D. | 0.1 mol•L-1 FeCl3溶液中:Fe2+、NH4+、SCN-、SO42- |
12.学习小组设计了如图实验(部分装置),将氯气依次通过下列装置以验证氯气的性质:
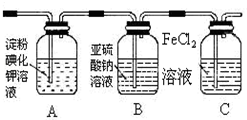
(1)通入氯气后,A中的现象是溶液变蓝色.C装置中发生反应的离子方程式为:2Fe2++Cl2═2Fe3++2Cl-.
(2)通入氯气一段时间后,洗气瓶B溶液中有一部分SO32-氧化成SO42-.设计试验方案,检验洗气瓶B溶液中Cl-和SO42-的存在.在答题卡上补充填写出实验步骤、预期现象和结论.
限选试剂及仪器:2mol/LHCl、2mol/LHNO3、1mol/LBaCl2溶液、lmol/LBa(NO3)2溶液、0.1mol/LAgNO3溶液、澄清石灰水、试管、胶头滴管.
(3)为准确测定通入氯气一段时间后剩余FeCl2的物质的量.实验如下:
①配制250mL 溶液:取洗气瓶C中全部溶液准确配制250mL溶液.
②滴定:准确量取25.00ml所配溶液于锥形瓶中,将0.1980mol/LKMnO4溶液装入酸式滴定管,滴定至终点,记录数据.重复滴定2次.平均消耗KMnO4溶液V mL.(反应式:Fe2++MnO4-+H+-Fe3++Mn2++H2O,未配平)
③计算250mL溶液中FeCl2的物质的量=$\frac{250}{25}$×0.1980×V×10-3×5 或10×0.1980×V×10-3×5 mol(只列出算式,不做运算).

(1)通入氯气后,A中的现象是溶液变蓝色.C装置中发生反应的离子方程式为:2Fe2++Cl2═2Fe3++2Cl-.
(2)通入氯气一段时间后,洗气瓶B溶液中有一部分SO32-氧化成SO42-.设计试验方案,检验洗气瓶B溶液中Cl-和SO42-的存在.在答题卡上补充填写出实验步骤、预期现象和结论.
限选试剂及仪器:2mol/LHCl、2mol/LHNO3、1mol/LBaCl2溶液、lmol/LBa(NO3)2溶液、0.1mol/LAgNO3溶液、澄清石灰水、试管、胶头滴管.
| 实验步骤 | 预期现象和结论 |
步骤1:取适量洗气瓶B中溶液于试管A中,滴加过量2mol/LHCl和1mol/LBaCl2溶液 振荡. | 若产生的白色沉淀,则洗气瓶B溶液中存在SO42- |
步骤2:另取适量洗气瓶B中溶液于试管B中,滴加滴加入过量lmol/LBa(NO3)2溶液 振荡,静置. | 产生白色沉淀. |
步骤3:取步骤2后试管B中的上层清液于试管C中, 滴加0.1mol/LAgNO3溶液和过量的2mol/LHNO3,振荡.. | 若产生白色沉淀,则洗气瓶B溶液中存在氯离子 |
①配制250mL 溶液:取洗气瓶C中全部溶液准确配制250mL溶液.
②滴定:准确量取25.00ml所配溶液于锥形瓶中,将0.1980mol/LKMnO4溶液装入酸式滴定管,滴定至终点,记录数据.重复滴定2次.平均消耗KMnO4溶液V mL.(反应式:Fe2++MnO4-+H+-Fe3++Mn2++H2O,未配平)
③计算250mL溶液中FeCl2的物质的量=$\frac{250}{25}$×0.1980×V×10-3×5 或10×0.1980×V×10-3×5 mol(只列出算式,不做运算).
9.${\;}_{15}^{25}$P是我国最近合成的一种新核素,下列有关${\;}_{15}^{25}$P表示的磷原子的说法中正确的是( )
| A. | 核外有25个电子 | |
| B. | 是一种新元素 | |
| C. | 核内有15个质子,核外有10个电子 | |
| D. | 质量数为25,原子序数为15,核内有10个中子 |
16.在给定的四种溶液中加入以下各种离子,能在原溶液中较大量共存的是( )
| A. | PH<7的溶液:Cu2+、Na+、Mg2+、NO3- | |
| B. | 滴加酚酞试液显红色的溶液:Fe3+、NH4+、Cl-、NO3- | |
| C. | 所含溶质为NaOH的溶液中:K+、SO42-、NO3-、H+ | |
| D. | 在碱性溶液:K+、HCO3-、Br-、Ba2+ |
17.“纳米材料”是粒子直径为1~100nm的材料,纳米碳就是其中一种.将纳米碳均匀分散到蒸馏水中得到一种分散系,下列有关该分散系的说法错误的是( )
| A. | 属于溶液 | B. | 能产生丁达尔效应 | ||
| C. | 分散质粒子能透过滤纸 | D. | 纳米碳粒子能够发生布朗运动 |
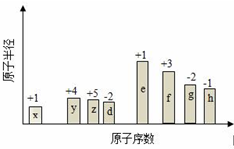 随原子序数的递增,八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如图所示.
随原子序数的递增,八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如图所示.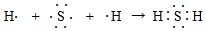 .
.