题目内容
3.下列根据反应原理设计的实际应用不正确的是( )| A. | CO32-+H2O HCO3-+OH-; 用热的纯碱溶液清洗油污 | |
| B. | SnCl2+H2OSn( OH)Cl+HCl;配制氯化亚锡溶液时加入氢氧化钠溶液 | |
| C. | A13++3HCO3-=Al (OH)3↓+3CO2↑;泡沫灭火器灭火 | |
| D. | A13++3H2OAl (OH)3(胶体)+3H+;明矾净水 |
分析 A.纯碱水解显碱性,可促进油污的水解;
B.氢氧化钠会促进SnCl2水解;
C.A13+与HCO3-发生相互促进的水解反应生成二氧化碳气体,能灭火;
D.铝离子水解生成的氢氧化铝胶体能吸附水中的悬浮颗粒.
解答 解:A.纯碱水解显碱性,即CO32-+H2O?HCO3-+OH-,可促进油污的水解,加热碳酸钠溶液的碱性增强,故A正确;
B.SnCl2在溶液中水解显酸性,加氢氧化钠会促进SnCl2水解,所以配制氯化亚锡溶液时加入HCl抑制水解,故B错误;
C.A13+与HCO3-发生相互促进的水解反应生成二氧化碳气体,即A13++3HCO3-=Al (OH)3↓+3CO2↑,反应生成大量的二氧化碳能灭火,故C正确;
D.明矾在水中电离出铝离子,铝离子水解生成的氢氧化铝胶体,即A13++3H2O?Al (OH)3(胶体)+3H+,氢氧化铝胶体能吸附水中的悬浮颗粒而净水,故D正确.
故选B.
点评 本题考查了盐类水解及应用、物质的性质与用途等,综合考查元素化合物知识及化学反应原理,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
13.有机物的种类繁多,但其命名是有规则的.下列有机物命名正确的是( )
| A. |  2-乙基丁烷 2-乙基丁烷 | B. | CH3CHBr2二溴乙烷 | ||
| C. |  2-甲基丁烯 2-甲基丁烯 | D. | 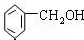 苯甲醇 苯甲醇 |
14.已知只有质子数或中子数为奇数的原子核有核磁共振(NMR)现象,试判断下列哪组原子均可产生NMR现象( )
| A. | 18O 31P 35Cl | B. | 27Al 19F 12C | ||
| C. | 第一周期所有元素的原子 | D. | 元素周期表中ⅤA所有元素的原子 |
18.对下列各溶液中,微粒的物质的量浓度关系表述正确的是( )
| A. | 某溶液中存在的离子只有Cl-、OH-、NH4+、H+,该溶液中离子浓度大小关系可能为:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 0.1mol•L-1(NH4)2SO4溶液中:c(H+)>c(NH4+) | |
| C. | 0.1mol•L-1的HCl溶液与0.1mol•L-1的NaOH溶液等体积混合:c(H+)+c(Na+)═c(OH-)+c(Cl-) | |
| D. | 0.1mol•L-1 CH3COONa溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
8.NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 标准状况下,11.2L的戊烷所含的分子数为0.5 NA | |
| B. | 26g乙炔所含共价键数目为2 NA | |
| C. | 标准状况下,11.2 L CCl4所含分子数为0.5 NA | |
| D. | 现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3 NA |
15.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | pH=1的溶液中:Na+、K+、MnO4-、CO32- | |
| B. | c(H+)=1×10-13mol•L-1的溶液中:Mg2+、Cu2+、SO42-、NO3- | |
| C. | 0.1 mol•L-1 NH4HCO3溶液中:K+、Na+、NO3-、Cl- | |
| D. | 0.1 mol•L-1 FeCl3溶液中:Fe2+、NH4+、SCN-、SO42- |
12.学习小组设计了如图实验(部分装置),将氯气依次通过下列装置以验证氯气的性质:
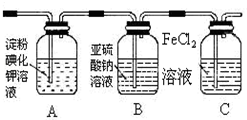
(1)通入氯气后,A中的现象是溶液变蓝色.C装置中发生反应的离子方程式为:2Fe2++Cl2═2Fe3++2Cl-.
(2)通入氯气一段时间后,洗气瓶B溶液中有一部分SO32-氧化成SO42-.设计试验方案,检验洗气瓶B溶液中Cl-和SO42-的存在.在答题卡上补充填写出实验步骤、预期现象和结论.
限选试剂及仪器:2mol/LHCl、2mol/LHNO3、1mol/LBaCl2溶液、lmol/LBa(NO3)2溶液、0.1mol/LAgNO3溶液、澄清石灰水、试管、胶头滴管.
(3)为准确测定通入氯气一段时间后剩余FeCl2的物质的量.实验如下:
①配制250mL 溶液:取洗气瓶C中全部溶液准确配制250mL溶液.
②滴定:准确量取25.00ml所配溶液于锥形瓶中,将0.1980mol/LKMnO4溶液装入酸式滴定管,滴定至终点,记录数据.重复滴定2次.平均消耗KMnO4溶液V mL.(反应式:Fe2++MnO4-+H+-Fe3++Mn2++H2O,未配平)
③计算250mL溶液中FeCl2的物质的量=$\frac{250}{25}$×0.1980×V×10-3×5 或10×0.1980×V×10-3×5 mol(只列出算式,不做运算).

(1)通入氯气后,A中的现象是溶液变蓝色.C装置中发生反应的离子方程式为:2Fe2++Cl2═2Fe3++2Cl-.
(2)通入氯气一段时间后,洗气瓶B溶液中有一部分SO32-氧化成SO42-.设计试验方案,检验洗气瓶B溶液中Cl-和SO42-的存在.在答题卡上补充填写出实验步骤、预期现象和结论.
限选试剂及仪器:2mol/LHCl、2mol/LHNO3、1mol/LBaCl2溶液、lmol/LBa(NO3)2溶液、0.1mol/LAgNO3溶液、澄清石灰水、试管、胶头滴管.
| 实验步骤 | 预期现象和结论 |
步骤1:取适量洗气瓶B中溶液于试管A中,滴加过量2mol/LHCl和1mol/LBaCl2溶液 振荡. | 若产生的白色沉淀,则洗气瓶B溶液中存在SO42- |
步骤2:另取适量洗气瓶B中溶液于试管B中,滴加滴加入过量lmol/LBa(NO3)2溶液 振荡,静置. | 产生白色沉淀. |
步骤3:取步骤2后试管B中的上层清液于试管C中, 滴加0.1mol/LAgNO3溶液和过量的2mol/LHNO3,振荡.. | 若产生白色沉淀,则洗气瓶B溶液中存在氯离子 |
①配制250mL 溶液:取洗气瓶C中全部溶液准确配制250mL溶液.
②滴定:准确量取25.00ml所配溶液于锥形瓶中,将0.1980mol/LKMnO4溶液装入酸式滴定管,滴定至终点,记录数据.重复滴定2次.平均消耗KMnO4溶液V mL.(反应式:Fe2++MnO4-+H+-Fe3++Mn2++H2O,未配平)
③计算250mL溶液中FeCl2的物质的量=$\frac{250}{25}$×0.1980×V×10-3×5 或10×0.1980×V×10-3×5 mol(只列出算式,不做运算).
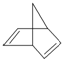 ,其分子式为C7H8.
,其分子式为C7H8. .
.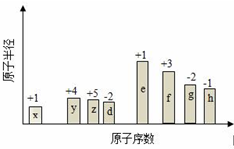 随原子序数的递增,八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如图所示.
随原子序数的递增,八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如图所示. .
.