题目内容
9.如图为元素周期表的一部分,a、b、c…为部分元素.回答下列问题: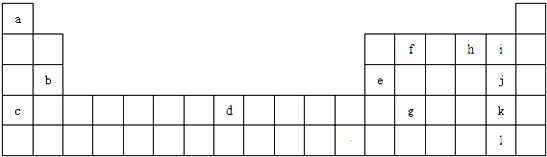
(1)请写出上述元素d的价电子排布式3d54s1;
(2)请写出j的单质与a、h形成的化合物发生反应的化学方程式Cl2+H2O=HClO+HCl;
(3)请比较b、e、j三种元素的第一电离能由大到小的顺序Cl>Mg>Al(写元素符号);
(4)请写出e元素最高价氧化物对应的水合物与a、c、h三种元素形成的化合物反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O;
(5)j、k、l三种元素之间能以原子个数比1:1两两形成互化物,这些互化物的性质类似于这些元素单质的性质.请写出k、l的互化物的电子式
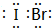 ,它是由σ键形成的(根据原子轨道的重叠程度填写).
,它是由σ键形成的(根据原子轨道的重叠程度填写).
分析 由图可知,a为H、b为Mg、c为K、d为Fe、e为Al、f为C、h为O,i为F,j为Cl,k为Br,l为I,g为Ge,
(1)Fe为第ⅤⅢ族元素,原子序数为26;
(2)氯气与水反应生成盐酸和HClO;
(3)非金属性越强,第一电离能越大,Mg的3s为全满稳定结构;
(4)氢氧化铝和NaOH反应生成偏铝酸钠和水;
(5)k、l的互化物为IBr,含I-br键,为共价单键.
解答 解:由图可知,a为H、b为Mg、c为K、d为Fe、e为Al、f为C、h为O,i为F,j为Cl,k为Br,l为I,g为Ge,
(1)Fe为第ⅤⅢ族元素,原子序数为26,则d的价电子排布式为3d54s1,故答案为:3d54s1;
(2)氯气与水反应生成盐酸和HClO,化学反应方程式为Cl2+H2O=HClO+HCl,故答案为:Cl2+H2O=HClO+HCl;
(3)非金属性越强,第一电离能越大,Mg的3s为全满稳定结构,b、e、j三种元素的第一电离能由大到小的顺序为Cl>Mg>Al,故答案为:Cl>Mg>Al;
(4)氢氧化铝和NaOH反应生成偏铝酸钠和水,反应离子方程式为Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(5)k、l的互化物为IBr,电子式为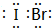 ,含I-br键,为共价单键,属于σ键形成的,故答案为:
,含I-br键,为共价单键,属于σ键形成的,故答案为: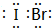 ;σ.
;σ.
点评 本题考查位置、结构及性质的应用,为高频考点,把握元素在周期表的位置、元素周期律、元素化合物知识等为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
19.已知反应2SO2(g)+O2(g)?2SO3(g),一定条件下发生反应生成2molSO3,放出热量为197KJ.若在相同条件下,向密闭容器中通入2mol SO2和1molO2,反应达到平衡时放出热量Q,则下列关系式正确的是( )
| A. | Q=197KJ | B. | Q<197×2 KJ | C. | Q<197KJ | D. | Q>197KJ |
4.下列化合物,按其晶体的熔点由高到低排列正确的是( )
| A. | SiO2、CsCl、CF4、CBr4 | B. | CsCl、SiO2、CBr4、CF4 | ||
| C. | SiO2、CsCl、CBr4、CF4 | D. | CF4、CBr4、CsCl、SiO2 |
14.下列物质不属于有机物的是( )
| A. | C2H4 | B. | C12H22O11 | C. | C60 | D. | HCOOH |
1.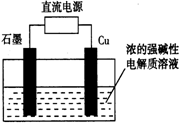 Cu2O可由电解制取,如图所示,电解总反应:2Cu+H2O=Cu2O+H2↑.下列说法正确的是( )
Cu2O可由电解制取,如图所示,电解总反应:2Cu+H2O=Cu2O+H2↑.下列说法正确的是( )
 Cu2O可由电解制取,如图所示,电解总反应:2Cu+H2O=Cu2O+H2↑.下列说法正确的是( )
Cu2O可由电解制取,如图所示,电解总反应:2Cu+H2O=Cu2O+H2↑.下列说法正确的是( )| A. | 石墨电极上产生氢气 | B. | 铜电极发生还原反应 | ||
| C. | 铜电极接直流电源的负极 | D. | 该反应也可设计为原电池 |
18.某有机物CxHmOn完全燃烧时需要氧气的物质的量是该有机物的x倍,则其化学式中x、m、n的关系不可能是( )
| A. | m:n=2:1 | B. | m=2x | C. | x:m:n=1:2:1 | D. | m=2x+2 |
19.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 能使甲基橙变红的溶液:Mg2+、Na+、NO3-、Cl- | |
| B. | 0.1mol•L-1NH4Cl溶液:K+、Ba2+、OH-、CO32- | |
| C. | 0.1mol•L-1Fe(NO3)2溶液:H+、Al3+、SO42-、I- | |
| D. | 由水电离产生的c(H+)=10-12mol•L-1的溶液:NH4+、SO42-、HCO3-、Cl- |
