题目内容
4.下列化合物,按其晶体的熔点由高到低排列正确的是( )| A. | SiO2、CsCl、CF4、CBr4 | B. | CsCl、SiO2、CBr4、CF4 | ||
| C. | SiO2、CsCl、CBr4、CF4 | D. | CF4、CBr4、CsCl、SiO2 |
分析 不同晶体的熔点:一般为原子晶体>离子晶体>金属晶体>分子晶体;相同晶体从影响晶体熔沸点高低的因素分析.
解答 解:SiO2为原子晶体,CsCl为离子晶体,不同晶体的熔点:一般为原子晶体>离子晶体>金属晶体>分子晶体,
则SiO2熔点最高,其次为CsCl,CBr4和CF4都为分子晶体,分子的相对分子质量越大,分子间作用力越强,熔点越高,
则熔点:CBr4>CF4,
固有:SiO2>CsCl>CBr4>CF4,
故选A.
点评 本题考查晶体的类型与熔沸点的比较,题目难度不大,解答该类题目时要首先判断晶体的类型,晶体类型相同时,要注意晶体结构是否相似,把握影响晶体熔沸点的因素.

练习册系列答案
相关题目
12.某固体化合物A不导电,但熔化或溶于水都能完全电离.下列关于物质A的说法中,正确的是( )
| A. | A是非电解质 | B. | A是强电解质 | C. | A是共价化合物 | D. | A是弱电解质 |
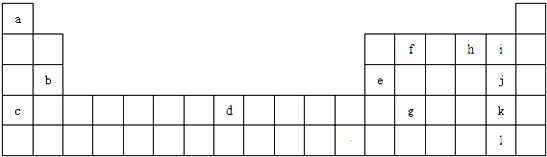
19.下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
(1)在这些元素中,化学性质最不活泼的是:Ar(填具体元素符号,下同).
(2)在最高价氧化物对应的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的电子式是: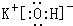 .
.
(3)最高价氧化物是两性氧化物的元素是Al;
(4)用电子式表示元素④与⑥的化合物的形成过程: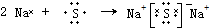 .
.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
(2)在最高价氧化物对应的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的电子式是:
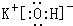 .
.(3)最高价氧化物是两性氧化物的元素是Al;
(4)用电子式表示元素④与⑥的化合物的形成过程:
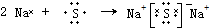 .
.
16.下列各表中的数字代表的是原子序数,表中数字所表示的元素与它们在周期表中位置相符的一组是( )
| A. |
| B. |
| C. |
| D. |
|
14.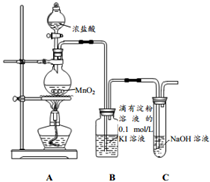 探究氯气与KI溶液的反应,某课外小组用如图装置进行实验(夹持仪器已略去,气密性已检验)
探究氯气与KI溶液的反应,某课外小组用如图装置进行实验(夹持仪器已略去,气密性已检验)
(1)装置A中生成氯气的化学反应方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)装置C中NaOH的作用是吸收多余氯气,防止污染环境;其中发生反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O.
(3)能证明氯气的氧化性强于碘的实验现象是B装置中通氯气后溶液变蓝.
(4)为探究B中溶液颜色变化的原因,该小组同学查阅资料并进行实验.
查阅资料:
I2和I-在溶液中会发生反应:I2+I-?I3-,I3-显棕黄色且遇淀粉变蓝;I2可被氯气与氧化为ICl2-(红色)和ICl4-(黄色),两种离子可继续被氧化成IO3-(无色).
进行实验:
①操作Ⅰ的实验目的是证明反应后的B溶液中有淀粉,无I3-,说明溶液的浅棕色不是I3-造成的.
②写出ICl2-在水溶液中与氯气反应生成IO3-的离子方程式ICl2-+2Cl2+3H2O=IO3-+6Cl-+6H+.
③由以上实验可推断B中溶液颜色变成浅棕色的原因是I-先被氯气氧化成I2,I2又被氯气氧化成ICl2-(红色)和ICl4-(黄色),两者混合呈浅棕色溶液.
 探究氯气与KI溶液的反应,某课外小组用如图装置进行实验(夹持仪器已略去,气密性已检验)
探究氯气与KI溶液的反应,某课外小组用如图装置进行实验(夹持仪器已略去,气密性已检验)| 实验操作 | 实验现象 |
| 打开A中分液漏斗活塞,放下部分浓盐酸,加热 | 装置B中溶液变蓝色,随后蓝色褪去,溶液显浅棕色 |
(2)装置C中NaOH的作用是吸收多余氯气,防止污染环境;其中发生反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O.
(3)能证明氯气的氧化性强于碘的实验现象是B装置中通氯气后溶液变蓝.
(4)为探究B中溶液颜色变化的原因,该小组同学查阅资料并进行实验.
查阅资料:
I2和I-在溶液中会发生反应:I2+I-?I3-,I3-显棕黄色且遇淀粉变蓝;I2可被氯气与氧化为ICl2-(红色)和ICl4-(黄色),两种离子可继续被氧化成IO3-(无色).
进行实验:
| 实验操作 | 实验现象 |
| Ⅰ.取反应后B中的溶液4mL分成两等份,第一份滴入1滴碘水;第二份滴入淀粉溶液 | 第一份溶液蓝色 第二份溶液颜色没有变化 |
| Ⅱ.将I2溶于KI溶液中配制得碘总浓度为0.1mol/L的溶液,取上述溶液2mL,滴加1滴淀粉溶液,再通入氯气 | 加淀粉后溶液变蓝,通氯气后蓝色褪去,溶液显浅棕色 |
| Ⅲ.向Ⅱ所得溶液继续通入氯气 | 溶液几乎变为无色 |
②写出ICl2-在水溶液中与氯气反应生成IO3-的离子方程式ICl2-+2Cl2+3H2O=IO3-+6Cl-+6H+.
③由以上实验可推断B中溶液颜色变成浅棕色的原因是I-先被氯气氧化成I2,I2又被氯气氧化成ICl2-(红色)和ICl4-(黄色),两者混合呈浅棕色溶液.

 ,它是由σ键形成的(根据原子轨道的重叠程度填写).
,它是由σ键形成的(根据原子轨道的重叠程度填写).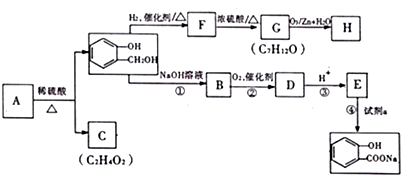
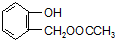 ,C含有的官能团是羧基;由F到G的反应类型为消去反应.
,C含有的官能团是羧基;由F到G的反应类型为消去反应.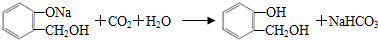 ;合适的试剂a为NaHCO3溶液.
;合适的试剂a为NaHCO3溶液.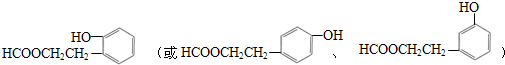 (写出一种即可).
(写出一种即可).