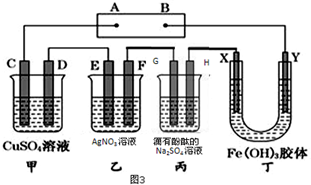
题目内容
下列叙述正确的是( )
| A、Na在氧气中燃烧主要生成Na2O |
| B、将SO2通入CaCl2溶液可生成CaSO3沉淀 |
| C、将CO2通入次氯酸钙溶液可生成次氯酸 |
| D、将NH3通入热的CuSO4溶液中能使Cu2+还原成Cu |
考点:钠的化学性质,氨的化学性质,二氧化硫的化学性质
专题:
分析:A.Na在氧气中燃烧主要生成Na2O2;
B.亚硫酸酸性比盐酸弱,BaSO3可溶于盐酸;
C.碳酸的酸性强于次氯酸;
D.NH3的还原性不强,还原性根本还原不了Cu2+.
B.亚硫酸酸性比盐酸弱,BaSO3可溶于盐酸;
C.碳酸的酸性强于次氯酸;
D.NH3的还原性不强,还原性根本还原不了Cu2+.
解答:
解:A.Na在氧气中燃烧主要生成Na2O2,常温下钠与氧气反应生成氧化钠,故A错误;
B.亚硫酸酸性比盐酸弱,SO2通入BaCl2溶液中不会生成BaSO3沉淀,故B错误;
C.碳酸的酸性强于次氯酸,依据强酸制弱酸的规律可知:将CO2通入次氯酸钙溶液中可生成次氯酸,故C正确;
D.NH3的还原性不强,还原性根本还原不了Cu2+,发生的反应是复分解反应,得到蓝色沉淀:CuSO4+2 NH3 +2 H2O=Cu(OH)2↓+(NH4)2 SO4
继续通入NH3,沉淀会溶解,得到蓝色溶液:Cu(OH)2+4 NH3=[Cu(NH3)4]2++2 OH-,故D错误;
故选C.
B.亚硫酸酸性比盐酸弱,SO2通入BaCl2溶液中不会生成BaSO3沉淀,故B错误;
C.碳酸的酸性强于次氯酸,依据强酸制弱酸的规律可知:将CO2通入次氯酸钙溶液中可生成次氯酸,故C正确;
D.NH3的还原性不强,还原性根本还原不了Cu2+,发生的反应是复分解反应,得到蓝色沉淀:CuSO4+2 NH3 +2 H2O=Cu(OH)2↓+(NH4)2 SO4
继续通入NH3,沉淀会溶解,得到蓝色溶液:Cu(OH)2+4 NH3=[Cu(NH3)4]2++2 OH-,故D错误;
故选C.
点评:本题考查了元素及其化合的性质,题目难度不大,熟悉物质的性质是解题关键,注意NH3通入热的CuSO4溶液中发生的化学反应.

练习册系列答案
相关题目
下列说法正确的是( )
A、
| ||||||
| B、强电解质中不含共价键 | ||||||
| C、25℃时,pH=9的Na2CO3溶液和pH=5的AlCl3溶液中,水的电离程度相同 | ||||||
| D、25℃时,pH=4.75、浓度均为0.1mol?L-1的CH3COOH、CH3COONa的c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+)混合溶液: |
“长征三号”丙运载火箭推进器常以联氨(N2H4)为燃料、过氧化氢为助燃剂.已知下列各物质反应的热化学方程式为:则联氨与过氧化氢反应的热化学方程式可表示为( )
N2H4(g)+O2(g)═N2(g)+2H2O(g)△H1=-533.23kJ?mol-1
H2O(g)═H2O(l)△H2=-44kJ?mol-1
2H2O2(l)═2H2O(l)+O2(g)△H3=-196.4kJ?mol-1.
N2H4(g)+O2(g)═N2(g)+2H2O(g)△H1=-533.23kJ?mol-1
H2O(g)═H2O(l)△H2=-44kJ?mol-1
2H2O2(l)═2H2O(l)+O2(g)△H3=-196.4kJ?mol-1.
| A、N2H4(g)+2H2O2(l)═N2(g)+4H2O(g)△H=+817.63 kJ?mol-1 |
| B、N2H4(g)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.63 kJ?mol-1 |
| C、N2H4(g)+2H2O2(l)═N2(g)+4H2O(g)△H=+641.63 kJ?mol-1 |
| D、N2H4(g)+2H2O2(l)═N2(g)+4H2O (g)△H=-817.63 kJ?mol-1 |
分析下表中各项的排布规律,按此规律排布对第29项X有关说法中不正确的是( )
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | … | 29 |
| C2H6 | C2H6O | C2H4O2 | C3H8 | C3H8O | C3H6O2 | C4H10 | … | X |
| A、X的分子式为C11H24O |
| B、X可能与金属钠反应生成氢气 |
| C、X可能与碳酸钠反应放出CO2气体 |
| D、X可能与第30项发生酯化反应 |
下列说法中正确的是( )
| A、合成纤维和光导纤维都是新型无机非金属材料 |
| B、乙醛、氯乙烯和乙二醇均可作为合成聚合物的单体 |
| C、淀粉、纤维素的化学式都可表示为(C6H10O5)n,二者互为同分异构体 |
| D、乙醛、乙酸和葡萄糖都能与新制的Cu(OH)2反应,且反应类型均为氧化反应 |
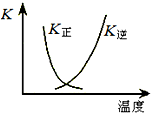 把a molO2和b mol SO2气体充入一密闭容器中,高温条件下发生反应O2+2SO2?2SO3
把a molO2和b mol SO2气体充入一密闭容器中,高温条件下发生反应O2+2SO2?2SO3
 请回答下列问题.
请回答下列问题.