题目内容
亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业.它在碱性环境中稳定存在.某同学查阅资料后设计生产NaClO2的主要流程如图.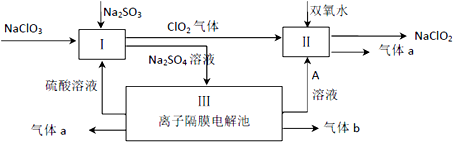
(1)配平Ⅰ中反应方程式:
ClO3-+ H++ SO32-= ClO2↑+ SO42-+
(2)A的化学式是 ,装置Ⅲ中A在 极区产生.生成气体a的电极反应式 .

(1)配平Ⅰ中反应方程式:
(2)A的化学式是
考点:氧化还原反应方程式的配平,电解原理
专题:
分析:(1)该反应中Cl元素化合价由+5价变为+4价、S元素化合价由+4价变为+6价,其转移电子总数为2,根据转移电子守恒、电荷守恒、原子守恒配平方程式;
(2)根据图知,III中电解质是Na2SO4,电解Na2SO4溶液时,阳极上电极反应式为2H2O-4e-=O2↑+4H+、阴极电极反应式为2H2O+2e-=H2↑+2OH-,所以a气体是氧气、b气体是氢气、A是NaOH,据此分析解答.
(2)根据图知,III中电解质是Na2SO4,电解Na2SO4溶液时,阳极上电极反应式为2H2O-4e-=O2↑+4H+、阴极电极反应式为2H2O+2e-=H2↑+2OH-,所以a气体是氧气、b气体是氢气、A是NaOH,据此分析解答.
解答:
解:(1)该反应中Cl元素化合价由+5价变为+4价、S元素化合价由+4价变为+6价,其转移电子总数为2,则ClO3-的计量数是2、SO32-的计量数是1,且生成水,再结合电荷守恒、原子守恒配平方程式得2ClO3-+2H++SO32-=2ClO2↑+SO42-+H2O,
故答案为:2;2;1;2;1;H2O;
(2)根据图知,III中电解质是Na2SO4,电解Na2SO4溶液时,阳极上电极反应式为2H2O-4e-=O2↑+4H+、阴极电极反应式为2H2O+2e-=H2↑+2OH-,左边流出硫酸,所以a气体是氧气,b气体是氢气、A是NaOH,A在阴极上生成,生成氧气的电极反应式为2H2O-4e-=O2↑+4H+,
故答案为:NaOH;阴;2H2O-4e-=O2↑+4H+.
故答案为:2;2;1;2;1;H2O;
(2)根据图知,III中电解质是Na2SO4,电解Na2SO4溶液时,阳极上电极反应式为2H2O-4e-=O2↑+4H+、阴极电极反应式为2H2O+2e-=H2↑+2OH-,左边流出硫酸,所以a气体是氧气,b气体是氢气、A是NaOH,A在阴极上生成,生成氧气的电极反应式为2H2O-4e-=O2↑+4H+,
故答案为:NaOH;阴;2H2O-4e-=O2↑+4H+.
点评:本题考查离子方程式的配平、电解原理等知识点,配平方程式时要注意原子守恒、电荷守恒和转移电子守恒,知道常见元素化合价,能从(2)流程图中分析中各个阶段发生的反应,题目难度不大.

练习册系列答案
相关题目
常温下,水的离子积为Kw,下列说法正确的是( )
| A、在pH=11的溶液中,水电离出的c(OH-)一定等于10-3mol/L |
| B、将pH=1的酸和pH=13的碱溶液等体积混合后,溶液的pH一定等于7 |
| C、一元酸HA与一元碱BOH混合后,溶液中c(A-)=c(B+),则溶液呈中性 |
| D、若强酸、强碱中和后溶液的pH=7,则中和之前酸、碱的pH之和一定等于14 |
下列关于有机化合物的叙述正确的是( )
| A、用NaOH溶液可以除去乙酸乙酯中的乙酸 |
| B、乙烯和苯都能与溴水反应而使溴水褪色 |
| C、用新制的银氨溶液可区分甲酸甲酯和乙醛 |
| D、脂肪、糖类和蛋白质都是人体重要的营养物质 |
分子式为C4H8O2且含有( )结构的同分异构体有几种(不考虑立体异构)( )
)结构的同分异构体有几种(不考虑立体异构)( )
 )结构的同分异构体有几种(不考虑立体异构)( )
)结构的同分异构体有几种(不考虑立体异构)( )| A、4 | B、5 | C、6 | D、8 |
下列叙述正确的是( )
| A、Na在氧气中燃烧主要生成Na2O |
| B、将SO2通入CaCl2溶液可生成CaSO3沉淀 |
| C、将CO2通入次氯酸钙溶液可生成次氯酸 |
| D、将NH3通入热的CuSO4溶液中能使Cu2+还原成Cu |
短周期主族元素A、B、C、D的原子序数依次增大.它们的原子序数之和为25,原子最外层电子数之和为
11. A与D同主族,且在周期表的S区.B与C是同周期相邻元素.则下列叙述正确的是( )
11. A与D同主族,且在周期表的S区.B与C是同周期相邻元素.则下列叙述正确的是( )
| A、四种元素的原子半径:A<B<C<D |
| B、四种元素A、B、C、D的氧化物都不止一种 |
| C、由B与A组成的化合物的沸点一定低于由C与A组成的化合物的沸点 |
| D、CaA2、CaB2这两种化合物中,阳离子与阴离子个数比均为1:2 |
 某学生利用锌与稀硫酸反应产生的氢气的体积,粗略测定锌的摩尔质量(设Wg锌片全部反应,产生气体的体积折算成标准状况时不超过50mL).实验装置如图请回答:(1)进行此试验时,必须保证气密性良好,如何检验此装置的气密性?
某学生利用锌与稀硫酸反应产生的氢气的体积,粗略测定锌的摩尔质量(设Wg锌片全部反应,产生气体的体积折算成标准状况时不超过50mL).实验装置如图请回答:(1)进行此试验时,必须保证气密性良好,如何检验此装置的气密性?