题目内容
3.关于下列氧化还原反应的说法正确的是( )| A. | 在2Al+2NaOH+2H2O═2NaAlO2+3H2反应中,水和氢氧化钠均作氧化剂 | |
| B. | Al分别于盐酸和氢氧化钠溶液反应,生成等质量的H2,转移的电子数相同 | |
| C. | CO2与Na2O2反应中,每生成1molO2,转移4mol电子 | |
| D. | 在Cu2S+4H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4+S↓+SO2↑+4H2O反应中,被氧化的元素只有硫 |
分析 A.Al元素化合价升高,水中H元素的化合价降低;
B.生成等质量的H2,H的得到电子数=Al失去电子数;
C.每生成1molO2,由O元素的化合价-1升高为0计算转移电子;
D.Cu元素的化合价由+1价升高为+2价,S元素的化合价由-2价升高为0.
解答 解:A.Al元素化合价升高,水中H元素的化合价降低,则该反应中水为氧化剂,故A错误;
B.生成等质量的H2,H的得到电子数=Al失去电子数,转移的电子数相同,故B正确;
C.每生成1molO2,由O元素的化合价-1升高为0可知转移电子为1mol×2×[0-(-1)]=2mol,故C错误;
D.Cu元素的化合价由+1价升高为+2价,S元素的化合价由-2价升高为0,则被氧化的元素为Cu、S,故D错误;
故选B.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,题目难度不大.

练习册系列答案
相关题目
14.某化学探究科研小组利用丙酮与溴在氯化氢做催化剂的条件下发生取代反应(CH3COCH3+Br2$\stackrel{HCl}{→}$CH3COCH2Br+HBr)来探究化学反应速率与反应物浓度的关系.如果化学反应速率v(Br2)用测定一定量的溴单质颜色消失所需要的时间来表示,在一定温度下,获得如下实验数据:
分析上述表格中的实验数据所得出的结论不正确的是( )
| 实验 序号 | 初始浓度c/(mol•L-1) | 溴颜色消失 所需时间t/s | ||
| CH3COCH3 | HCl | Br2 | ||
| ① | 1.60 | 0.40 | 0.0020 | 580 |
| ② | 3.20 | 0.40 | 0.0020 | 290 |
| ③ | 1.60 | 0.80 | 0.0020 | 290 |
| ④ | 1.60 | 0.40 | 0.0040 | 1160 |
| A. | 由①④实验对比,可以得出增大c(Br2),v(Br2)减小 | |
| B. | 由②③实验对比,可以得出实验②和③的v(Br2)相等 | |
| C. | 由①③实验对比,可以得出增大c(HCl),v(Br2)增大 | |
| D. | 由①②实验对比,可以得出增大c(CH3COCH3),v(Br2)增大 |
11.下列有关热化学方程式书写及对应表述均正确的是( )
| A. | 已知2C(s)+O2 (g)═2CO(g)△H=-221kJ/mol,则可知C的燃烧热△H=-110.5kJ/mol | |
| B. | 稀醋酸与0.1 mol/LNaOH溶液反应:H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol | |
| C. | 已知1 mol氢气完全燃烧生成液态水所放出的热量为285.5 kJ,则水分解的热化学方程式:2H2O(l)═2H2(g)+O2(g)△H=+285.5kJ/mol | |
| D. | 密闭容器中,9.6g硫粉与11.2g铁粉混合加热生成硫化亚铁17.6 g时,放出19.12 kJ热量.则Fe(s)+S(s)═FeS(s)△H=-95.6kJ/mol |
18.下列与金属腐蚀有关的说法正确的是( )
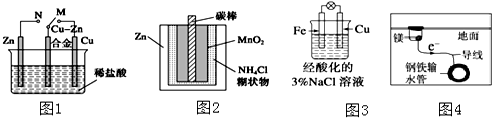

| A. | 图1中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小 | |
| B. | 图2中,Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的 | |
| C. | 图3中,滴加少量K3[Fe(CN)6]溶液,没有蓝色沉淀出现 | |
| D. | 图4中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的正极 |
8.下列说法正确的是( )
| 化学键 | C-H | C=C | C-C | H-H |
| 键能(KJ/mol) | 615.3 | 414.4 | 347.4 | 435.3 |
| A. | 已知则可以计算CH3-CH3(g)→CH2=CH2(g)+H2(g);△H=+125.6KJ/mol | |
| B. | NH3+H3O+=NH4++H2O,说明NH3结合H+能力比H2O强 | |
| C. | 室温下,用0.100mol.L-1NaOH溶液滴定20.00mL0.100mol.L-1的醋酸,V(NaOH)=10.00mL时,$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$<1 | |
| D. | 已知中和热为-57.4KJ/mol,则NaOH(aq)+CH3COOH(aq)=CH3COONa+H2O(l)△H=-57.4KJ/mol |
15.工业上用乙烯水合法制取乙醇,其反应为:C2H4(g)+H2O(g)C2H5OH(g)△H=a kJ•mol-1.将等物质的量的C2H4(g)和H2O(g)充入某装置制取乙醇,乙烯的平衡转化率随温度、压强的变化关系如图所示.(平衡时,可用气体分压代替平衡浓度计算平衡常数,气体分压=气体总压×体积分数)

下列说法正确的是( )

下列说法正确的是( )
| A. | a大于0,P1小于P2 | |
| B. | M点H2O(g)的转化率为10% | |
| C. | M点化学反应速率大于N点 | |
| D. | 250℃时,用平衡分压计算的化学平衡常数 KP=$\frac{9}{16}$ |
12. 酸性锌锰干电池是一种一次性电池,外壳为金属锌,中间是碳棒,其周围是有碳粉、MnO2、NH4Cl等组成的糊状填充物,其结构如下图.该电池在放电时发生的主要反应为:Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl2+2MnOOH
酸性锌锰干电池是一种一次性电池,外壳为金属锌,中间是碳棒,其周围是有碳粉、MnO2、NH4Cl等组成的糊状填充物,其结构如下图.该电池在放电时发生的主要反应为:Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl2+2MnOOH
回收处理该废旧电池可以得到多种化工原料,有关数据下图所示:溶解度/(g/100g水)
某化学课外小组设计了如下废旧电池综合利用工艺(不考虑废旧电池中实际存在的少量其他金属):

回答下列问题:
(1)该酸性锌锰干电池放电时的正极反应式为MnO2+e-+NH4+=MnOOH+NH3;
(2)晶体A的化学式为NH4Cl;
(3)操作③的名称为在空气中灼烧;
(4)从MnO2获得K2MnO4的反应方程式为3MnO2+KClO3+6KOH$\frac{\underline{\;\;△\;\;}}{\;}$3K2MnO4+KCl+3H2O;
(5)用废电池的锌皮制作ZnSO4•7H2O,需去除少量杂质铁,其方法是:
①加入足量的稀H2SO4和H2O2溶解.加入H2O2反应的离子方程式是2Fe2++H2O2+2H+=2Fe3++2H2O;
②加碱调节pH为3,使铁刚好完全沉淀,过滤.向滤液中继续加碱调节pH使锌刚好完全沉淀.过滤、洗涤.
③将沉淀溶于稀H2SO4,经过蒸发浓缩、冷却结晶(答操作名称)、过滤、洗涤、干燥得到ZnSO4•7H2O,晶体用冷水洗涤的原因是降低晶体的溶解度,减少损失.
 酸性锌锰干电池是一种一次性电池,外壳为金属锌,中间是碳棒,其周围是有碳粉、MnO2、NH4Cl等组成的糊状填充物,其结构如下图.该电池在放电时发生的主要反应为:Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl2+2MnOOH
酸性锌锰干电池是一种一次性电池,外壳为金属锌,中间是碳棒,其周围是有碳粉、MnO2、NH4Cl等组成的糊状填充物,其结构如下图.该电池在放电时发生的主要反应为:Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl2+2MnOOH回收处理该废旧电池可以得到多种化工原料,有关数据下图所示:溶解度/(g/100g水)
| 温度/℃ 化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
| NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
| ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-17 | 10-17 | 10-39 |

回答下列问题:
(1)该酸性锌锰干电池放电时的正极反应式为MnO2+e-+NH4+=MnOOH+NH3;
(2)晶体A的化学式为NH4Cl;
(3)操作③的名称为在空气中灼烧;
(4)从MnO2获得K2MnO4的反应方程式为3MnO2+KClO3+6KOH$\frac{\underline{\;\;△\;\;}}{\;}$3K2MnO4+KCl+3H2O;
(5)用废电池的锌皮制作ZnSO4•7H2O,需去除少量杂质铁,其方法是:
①加入足量的稀H2SO4和H2O2溶解.加入H2O2反应的离子方程式是2Fe2++H2O2+2H+=2Fe3++2H2O;
②加碱调节pH为3,使铁刚好完全沉淀,过滤.向滤液中继续加碱调节pH使锌刚好完全沉淀.过滤、洗涤.
③将沉淀溶于稀H2SO4,经过蒸发浓缩、冷却结晶(答操作名称)、过滤、洗涤、干燥得到ZnSO4•7H2O,晶体用冷水洗涤的原因是降低晶体的溶解度,减少损失.
13.足量NaHSO3溶液和Na2CO3溶液混合后能产生CO2气体,下列说法中正确的是( )
| A. | 反应的离子方程式:2H++CO32-═H2O+CO2↑ | |
| B. | 若向Na2CO3溶液中通入足量的SO2气体,也可得到CO2 | |
| C. | HSO3-的水解程度大于其电离程度 | |
| D. | 各级电离常数:K1(H2SO3)>K1(H2CO3)>K2(H2SO3)>K2(H2CO3) |
