题目内容
1.下列四个图象所反映的内容与相应反应符合的是(a、b、c、d均大于0)( )| A. | 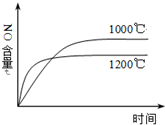 4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-a kJ•mol-1 | |
| B. | 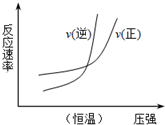 N2(g)+3H2(g)?2NH3(g)△H=+b kJ•mol-1 | |
| C. | 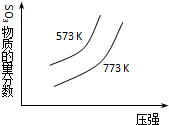 2SO2(g)+O2(g)?2SO3(g)△H=+C kJ•mol-1 | |
| D. | 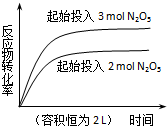 2N2O5(g)?4NO2(g)+O2(g)△H=+d kJ•mol-1 |
分析 A.该反应的正反应是放热反应,升高温度,平衡逆向移动,NO的含量减小;
B.该反应是一个反应前后气体计量数之和减小的可逆反应,恒温条件下,增大压强,正逆反应速率都增大,平衡向正反应方向移动,则正反应速率大于逆反应速率;
C.该反应的正反应为放热反应,升高温度,平衡逆向移动,则三氧化硫含量降低;
D.该反应的正反应是反应前后气体计量数之和增大的可逆反应,恒容条件下,增大反应物浓度,相当于增大压强,平衡逆向移动.
解答 解:A.该反应的正反应是放热反应,升高温度,平衡逆向移动,NO的含量减小,但反应速率增大,反应达到平衡时间减小,符合图象,故A正确;
B.该反应是一个反应前后气体计量数之和减小的可逆反应,恒温条件下,增大压强,正逆反应速率都增大,平衡向正反应方向移动,则正反应速率大于逆反应速率,所以正逆反应速率相等后,正反应速率曲线在上面,故B错误;
C.该反应的正反应是放热反应,升高温度,平衡逆向移动,则三氧化硫含量降低,所以773K的曲线纵坐标小于573K的,不符合图象,故C错误;
D.该反应的正反应是反应前后气体计量数之和增大的可逆反应,恒容条件下,增大反应物浓度,相当于增大压强,平衡逆向移动,则五氧化二氮的转化率降低,图象不符合,故D错误;
故选A.
点评 本题考查图象分析,侧重考查影响化学平衡移动因素、化学反应速率影响因素,明确外界条件对反应速率及平衡移动的影响原理是解本题关键,易错选项是B,注意:反应速率图象中,哪个方向反应速率较大,平衡就向哪个方向移动.

练习册系列答案
相关题目
14.X、Y、Z、M、G五种主族元素分属三个短周期,且原子序数依次增大.X、Z同主族,可形成离子化合物 ZX;Y、M同主族,可形成 MY2、MY3两种分子.
请回答下列问题:
(1)Y在元素周期表中的位置为第二周期第ⅥA族;
(2)上述元素的最高价氧化物对应的水化物酸性最强的是HClO4(写化学式),非金属气态氢化物还原性最强的是H2S(写化学式);
(3)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有Cl2、O3
(写出其中两种物质的化学式);
(4)ZX与水反应放出气体的化学方程式为NaH+H2O=NaOH+H2↑;
(5)探究同主族元素性质的一些共同规律,是学习化学的重要方法之一.元素 E位于第四周期,与元素 Y同主族.在下表中列出对 H2EO3各种不同化学性质的推测,举例并写出相应的化学方程式(化学方程式中 E用元素符号表示)
(6)由碳元素(C)、Y和 M三种元素组成的化合物 CYM中,所有原子的最外层满足 8电子结构.写出该化合物的电子式(电子式中 Y、M用元素符号表示)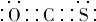 .
.
请回答下列问题:
(1)Y在元素周期表中的位置为第二周期第ⅥA族;
(2)上述元素的最高价氧化物对应的水化物酸性最强的是HClO4(写化学式),非金属气态氢化物还原性最强的是H2S(写化学式);
(3)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有Cl2、O3
(写出其中两种物质的化学式);
(4)ZX与水反应放出气体的化学方程式为NaH+H2O=NaOH+H2↑;
(5)探究同主族元素性质的一些共同规律,是学习化学的重要方法之一.元素 E位于第四周期,与元素 Y同主族.在下表中列出对 H2EO3各种不同化学性质的推测,举例并写出相应的化学方程式(化学方程式中 E用元素符号表示)
| 编号 | 性质推测 | 化学方程式 |
| 示例 | 氧化性 | H2EO3+4HI═Z↓+2I2+3H2O |
| 1 | ||
| 2 |
 .
.
9.C6H14的各种同分异构体中,所含甲基数和它的一氯取代物的数目与下列情况相符的是( )
| A. | 4个-CH3,能生成4种一氯取代物 | B. | 3个-CH3,能生成3种一氯取代物 | ||
| C. | 3个-CH3,能生成4种一氯取代物 | D. | 2个-CH3,能生成4种一氯取代物 |
16.下列叙述中不正确的是( )
| A. | 人类大规模开发、利用金属,铁比铝早 | |
| B. | 依据酸碱质子理论HCO3-是酸碱两性物质 | |
| C. | 因为铜比铁不活泼,所以铜与氯化铁溶液不会发生化学反应 | |
| D. | 煤燃烧前加入适量的石灰可以减少污染 |
13.某学生用碱式滴定管量取0.1mol•L-1的NaOH溶液,开始时仰视液面读数为1.00mL,取出部分溶液后,俯视液面,读数为11.00mL,该同学在操作中实际取出的液体体积为( )

| A. | 大于10.00 mL | B. | 小于10.00 mL | C. | 等于10.00 mL | D. | 不能确定 |
10.下列有关物质性质或应用的说法不正确的是( )
| A. | 石油分馏可获得乙烯、丙烯和丁二烯 | |
| B. | 盐析可提纯蛋白质并保持其生理活性 | |
| C. | 从煤焦油中可分离出苯、甲苯及二甲苯 | |
| D. | 锂具有还原性、导电性和比能量高,可用作锂电池的负极材料 |
11.如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化.下列说法正确的是( )
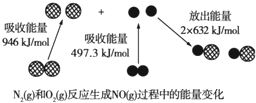

| A. | 通常情况下,NO比N2稳定 | |
| B. | 通常情况下,N2(g)和O2(g)混合能直接反应生成NO | |
| C. | 1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的能量 | |
| D. | 1 mol N2(g)和1 mol O2(g)反应放出的能量为179.3 kJ |
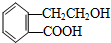 ,它可通过不同化学反应分别制得B、C、D和E四种物质.
,它可通过不同化学反应分别制得B、C、D和E四种物质.
 ;
;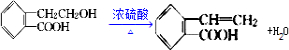 .
.