题目内容
【题目】硫单质及其化合物在化工生成等领城应用广泛。
(1)工业尾气中的SO2一直是环境污染的主要原因之一,工业上常采用如下方法降低尾气中的含硫量:
①方法 1: 燃煤中加入生石灰,将SO2转化为 CaSO3,再氧化为CaSO4。
已知:a. CaO(s) +CO2 (g)=CaCO3 △H=-1 78.3kJmol-1
b. 2CaCO3(s) +2SO2(g) +O2(g)=2CaSO4(s) +2CO2(g) △H=-2762.2kJmol-1
c.2 CaSO3(s) + O2(g)=2CaSO4(s) △H =-2314.8 kJmol-1
写出CaO(s)与SO2(g)反应生成CaSO3(s)的热化学方程式:_____________。
②方法 2:用氨水将SO2转化为NH4HSO3 ,再氧化为(NH4)2SO4。实验测得NH4HSO3溶液中![]() = 1500 ,则溶液的pH 为_____________(已知:HSO3-的Ka1=1.5×l0-2, Ka2=l.0×l0-7)。
= 1500 ,则溶液的pH 为_____________(已知:HSO3-的Ka1=1.5×l0-2, Ka2=l.0×l0-7)。
(2)煤制得的化工原料气中含有羰基硫(O=C =S),该物质可转化为H2S,反应为COS(g)+ H2( g ) ![]() H2S(g) +CO(g) △H > 0。
H2S(g) +CO(g) △H > 0。
①恒温恒容条件下,密闭容器中发生上述反应,下列事实不能说明反应达到平衡状态的是________________(填字母)。
a.COS的浓度保持不变 b. 化学平衡常数不再改变
c.混合气体的密度不再改变 d. 形成 2 mol H-S 键的同时形成 1 mol H-H 键
②T℃时 ,在恒容的密闭容器中 ,将定量的CO和H2S 混合加热并达到下列平衡:H2S(g) + CO(g)![]() COS(g) + H2(g),K=0.25,则该温度下反应 COS(g) +H2(g)=H2S(g) +CO(g)的平衡常数K __________。T1℃ 时,向容积为 10 L 的恒容密闭容器中充入 1 molCOS(g)和1 mol H2 (g),达到平衡时 COS 的转化率为_______。
COS(g) + H2(g),K=0.25,则该温度下反应 COS(g) +H2(g)=H2S(g) +CO(g)的平衡常数K __________。T1℃ 时,向容积为 10 L 的恒容密闭容器中充入 1 molCOS(g)和1 mol H2 (g),达到平衡时 COS 的转化率为_______。
(3)过二硫酸(H2S2O8)是一种强氧化性酸,其结构式如图所示: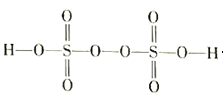
①在Ag+催化作用下,S2O82-能与 Mn2+ 在水溶液中发生反应生成SO42-和 MnO4-,1 molS2O82-能氧化的 Mn2+ 的物质的量为_____________mol。
②工业上可用惰性电极电解硫酸和硫酸铵混合溶液制备过二硫酸铵。则阳极的电极反应式为______________________。
(4)NaHS 可用作处理含 Hg2+的污水的沉淀剂,已知 25℃时,反应 Hg2+(aq) + HS-( aq) ![]() HgS(s) + H+(aq) 的平衡常数 K=l.75×l038 ,H2S的电离平衡常数Ka1=1.3×l0-7 , Ka2= 7.0×l 0-15,则Ksp(HgS) =__________________。
HgS(s) + H+(aq) 的平衡常数 K=l.75×l038 ,H2S的电离平衡常数Ka1=1.3×l0-7 , Ka2= 7.0×l 0-15,则Ksp(HgS) =__________________。
【答案】CaO (s) + SO2(g}= CaCO3(s) △H=-402.0kJmoj-1 6 bc 4 66. 7% 0.4 2SO42--2e一= S2O82- 4.0×10-53
【解析】
(1)①已知:a. CaO(s)+CO(g)=CaCO3(s) ΔH=-178.3kJ·mol-1
b.2CaCO3(s)+2SO2(g)+O2(g)=2CaSO4(s)+2CO2(g) ΔH=-2762.2kJ·mol-1
c.2CaSO3(s)+O2(g)=2CaSO4(s) ΔH=-2314.8kJ·mol-1
根据盖斯定律(b-c)/2+a即得到CaO(s)与SO2(g)反应生成CaSO3(s)的热化学方程式:CaO(s)+SO2(g)=CaSO3(s) ΔH=-402.0kJ·mol-1。
②Ka1=c(H+)c(HSO3-)/c(H2SO3)、Ka2=c(H+)c(SO32-)/c(HSO3-),则Ka1Ka2=c2(H+)·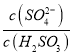 =1.5×10-2×1.0×10-7,解得c(H+)=1×10-6,溶液的pH为6。
=1.5×10-2×1.0×10-7,解得c(H+)=1×10-6,溶液的pH为6。
(2)COS(g) +H2(g)![]() H2S(g)+CO(g) ΔH>0。
H2S(g)+CO(g) ΔH>0。
①恒温恒容条件下,密闭容器中发生上述反应,a.COS的浓度保持不变说明化学反应达到平衡状态了;b.化学平衡常数只和温度有关,不受浓度影响,所以不能作为判断平衡的依据;c.混合气体的密度=m/V,恒容V定值,都是气体所以m不变,故c不能;d.形成2molH-S键的同时形成1mol H-H键说明正逆反应速率相等,故可以作为判断平衡的标志。答案:bc。
②T1℃时H2S(g)+ CO(s) ![]() COS(g)+H2(g)的K=c(COS)c(H2)/c(CO)c(H2S)=0.25,COS(g)+H2(g)=H2S(g)+ CO(s)的K=c(CO)c(H2S)/c(COS)c(H2))=1/0.25=4。
COS(g)+H2(g)的K=c(COS)c(H2)/c(CO)c(H2S)=0.25,COS(g)+H2(g)=H2S(g)+ CO(s)的K=c(CO)c(H2S)/c(COS)c(H2))=1/0.25=4。
③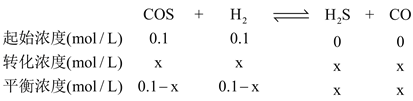
K=x·x/(0.1-x)·(0.1-x)=4,解得x=0.0667,COS的转化率为0.0667/0.1×100%=66.7%。
3)①根据方程式5S2O82-+ 2Mn2+ +8H2O=10SO42-+2MnO4-+16H+可知1mol S2O82-能氧化的Mn2+的物质的量为0.4mol。
②用惰性电极电解硫酸和硫酸铵混合溶液制备过二硫酸铵。根据氧化还原原理知阳极SO42-失电子,则阳极的电极反应式为2SO42--2e-=S2O82-。
(4) 由已知反应a. Hg2+(aq) + HS-( aq) ![]() HgS(s) + H+(aq) K=l.75×l038
HgS(s) + H+(aq) K=l.75×l038
b. HS-( aq) ![]() H+(aq) + S2-( aq) Ka2= 7.0×l 0-15
H+(aq) + S2-( aq) Ka2= 7.0×l 0-15
反应b-a得HgS(s) ![]() Hg2+(aq) + S2- (aq),则Ksp(HgS) =
Hg2+(aq) + S2- (aq),则Ksp(HgS) =![]() =4.0×10-53。
=4.0×10-53。

 习题精选系列答案
习题精选系列答案