题目内容
【题目】钴(Co)是生产耐热合金、硬质合金、防腐合金、磁性合金和各种钴盐的重要原料,其金属性弱于 Fe 强于 Cu。某低位硫钴铜矿的成分为:CoS、CuFeS2、CaS、SiO2, 一种利用生物浸出并回收其中钴和铜的工艺流程如图:
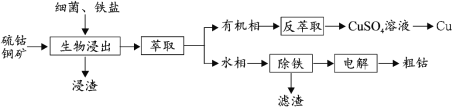
回答下列问题:
(1)Cu2+的生物浸出原理如下:
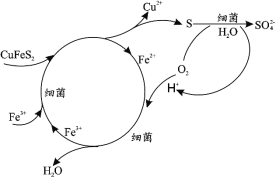
温度超过 50℃浸出率急剧下降,其原因是_____;其他金属离子的浸出原理与上图类似, 写出由 CoS 浸出 Co2+的离子方程式_____。
(2)浸出渣的主要成分为_____。
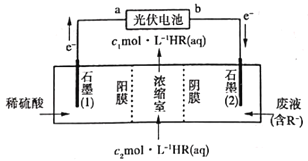
(3)萃取分离铜的原理如下:Cu2++2(HR)org![]() (CuR2)org+2H+。根据流程,反萃取加入的试剂应该为_____(写化学式)。
(CuR2)org+2H+。根据流程,反萃取加入的试剂应该为_____(写化学式)。
(4)除铁步骤中加入 H2O2,调节溶液的 pH 至 4,将 Fe2+转化为 FeOOH 过滤除去,写出该转化的离子方程式为_____。检验 Fe2+是否完全被转化的试剂为_____。
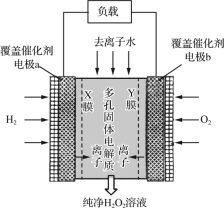
(5)通过电解法制得的粗钴含有少量铜和铁,需要电解精炼,进行精炼时,精钴应处于_____极(填“阴”或“阳”),阳极泥的主要成分为_____。
【答案】温度过高细菌失活 ![]() CaSO4、SiO2 H2SO4
CaSO4、SiO2 H2SO4 ![]() 铁氰化钾 阴 铜
铁氰化钾 阴 铜
【解析】
(1)温度过高细菌失活,浸出率急剧下降,根据Cu2+的生物浸出推断Co2+的生物浸出;
(2)由生物浸出原理图可知S元素最终转化为SO42-,与Ca2+结合生成CaSO4沉淀,SiO2不参与反应,金属阳离子进入滤液;
(3)根据平衡移动原理可知,反萃取需加入酸,由流程图可知反萃取后得到CuSO4溶液。则应加入硫酸;
(4)H2O2和Fe2+反应生成FeOOH沉淀,根据电荷守恒和原子守恒配平方程;亚铁离子遇到铁氰化钾会生成深蓝色的沉淀,故检验亚铁离子可选用铁氰化钾溶液;
(5)电解精炼时粗钴为阳极,放电顺序为Fe>Co>Cu,精钴为阴极电解质为CoSO4,以此分析。
(1)温度过高细菌失活,浸出率急剧下降;根据Cu2+的生物浸出可知矿物再细菌和Fe3+作用下化合物中S元素转化为S单质,则Co2+的生物浸出离子方程式为:![]() ,故答案为 :温度过高细菌失活;
,故答案为 :温度过高细菌失活;![]() ;
;
(2)由生物浸出原理图可知S元素最终转化为SO42-,与Ca2+结合生成CaSO4,SiO2不参与反应,金属阳离子进入滤液,则浸出渣的主要成分为CaSO4、SiO2,故答案为:CaSO4、SiO2;
(3)根据平衡移动原理可知,反萃取需加入酸,由流程图可知反萃取后得到CuSO4溶液。则应加入硫酸,故答案为:H2SO4;
(4)H2O2和Fe2+反应生成FeOOH沉淀,离子方程式为![]() 。检验检验亚铁离子可用铁氰化钾溶液,若生成蓝色沉淀则存在亚铁离子,故答案为:
。检验检验亚铁离子可用铁氰化钾溶液,若生成蓝色沉淀则存在亚铁离子,故答案为:![]() ;铁氰化钾;
;铁氰化钾;
(5)电解精炼时粗钴为阳极,精钴做阴极。电解精炼时,Fe和Co溶解,Cu较不活泼,不能溶解,因此,阳极泥主要为铜,故答案为:阴;铜。

 阅读快车系列答案
阅读快车系列答案