题目内容
【题目】设NA表示阿伏加德罗常数,下列叙述中正确的是( )
A.常温常压下,11.2L氧气所含的原子数为NA
B.1.8gNH4+离子中含有的电子数为NA
C.常温常压下,48gO3含有的氧原子数为NA
D.5.6g金属铁与足量氯气充分反应时失去的电子数为0.2NA
【答案】B
【解析】
A.常温常压下,气体摩尔体积大于22.4L/mol,故11.2L氧气的物质的量小于0.5mol,故所含的氧原子个数小于NA个,A项错误;
B.1.8g铵根离子的物质的量为0.1mol,而一个铵根离子中含10个电子,故0.1mol铵根离子中含NA个电子,B项正确;
C.臭氧由氧原子构成,故48g臭氧中含有的氧原子的物质的量n=![]() =3mol,故含3NA个氧原子,C项错误;
=3mol,故含3NA个氧原子,C项错误;
D.5.6g铁的物质的量为0.1mol,而铁和氯气反应后变为+3价,故0.1mol铁反应后失去0.3NA个电子,D项错误。
答案选B。

 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案【题目】下列实验描述、对应的现象以及结论都正确的是( )
选项 | 实验 | 现象 | 结论 |
A | 向滴有酚酞的Na2CO3溶液中加入BaCl2固体 | 溶液红色变浅 | Na2CO3溶液中存在水解平衡 |
B | 处理锅炉水垢中的CaSO4 时,依 次加入饱和Na2CO3溶液和盐酸 | 水垢溶解 | Ksp:CaCO3>CaSO4 |
C | 其它条件不变,平衡体系: FeCl3(aq)+3KSCN(aq) +3KCl(aq)中,加KCl 固体 | 红色变浅 | 证明增大生成物KCl的浓度,使原溶液中化学平衡逆向移动 |
D | 向浓度均为0.1 mol·L-1的NaCl和NaI混合溶液中滴加少量AgNO3溶液 | 先出现 黄色沉淀 | Ksp:AgCl<AgI |
A. A B. B C. C D. D
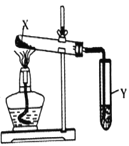
【题目】按图装置进行实验,下列现象能推断出结论的是( )
选项 | 试剂X | Y中试剂及现象 | 结论 | 装置 |
A | 一种盐 | 酚酞溶液未变红 | 该盐不可能是铵盐 |
|
B | 小苏打和纯碱 | 石灰水变浑浊 | 纯碱比小苏打稳定 | |
C | 氢氧化钙与氯化铵 | 硝酸银溶液中先产生沉淀后溶解 | Ag2O能溶于氨水 | |
D | 氯酸钾与二氧化锰 | 淀粉、碘化钾和和硫酸的混合溶液变蓝 | 反应产生了Cl2 |
A. A B. B C. C D. D