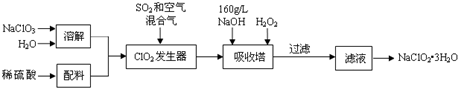
题目内容
18.某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图Ⅰ-Ⅳ所示.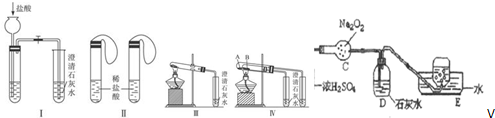
(1)只根据图Ⅰ、Ⅱ所示实验,能够达到实验目的是(填装置序号)II.
(2)图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,其反应的化学方程式为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑;CO2+Ca(OH)2=CaCO3↓+H2O.
(3)若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体最好是(填化学式)NaHCO3.
(4)将碳酸氢钠溶液与澄清石灰水混合并充分反应.
①当石灰水过量时,其离子方程式为Ca2++OH-+HCO3-═CaCO3↓+H2O.
②当碳酸氢钠与氢氧化钙物质的量之比为2:1时,所得溶液中溶质的化学式为Na2CO3
(5)若将图Ⅲ中导管直接与图V装置干燥管相连,则图V装置中C中可能发生的化学反应化学方程式2Na2O2+2CO2=2Na2CO3+O2、2Na2O2+2H2 O=4NaOH+O2.
分析 (1)实验Ⅰ中,无论碳酸钠还是碳酸氢钠都能和盐酸反应生成二氧化碳,二氧化碳能使澄清的石灰水变浑浊;碳酸钠和盐酸反应分两步进行,盐酸和碳酸钠、碳酸氢钠反应都生成二氧化碳,二氧化碳能使澄清的石灰水变浑浊;
(2)碳酸氢钠不稳定,在加热条件下能分解生成碳酸钠、二氧化碳和水,碳酸钠较稳定,加热不易分解;Ⅳ
(3)B加热温度较低,可将碳酸氢钠在较低温度下加热,不直接加热碳酸氢钠就能分解更说明碳酸氢钠不稳定;
(4)①碳酸氢钠与过量的氢氧化钙溶于反应生成碳酸钙沉淀和氢氧化钠;
②碳酸氢钠与氢氧化钙的物质的量之比为2:1时,反应方程式为2NaHCO3+Ca(OH)2=CaCO3↓+Na2CO3+2H2O;
(5)碳酸氢钠分解生成二氧化碳和水蒸气,二氧化碳、水蒸气与过氧化钠反应.
解答 解:(1)Ⅰ装置反应现象相同;Ⅱ装置,向碳酸钠溶液中滴加盐酸先没有气体生成,随着盐酸的不断滴加,后产生气泡,向碳酸氢钠溶液中滴加盐酸立即产生气泡,所以能够达到实验目的是Ⅱ,
故答案为:Ⅱ;
(2)碳酸氢钠在加热条件下能分解生成碳酸钠、水和二氧化碳2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,生成的二氧化碳与澄清石灰水反应生成碳酸钙,反应的方程式为CO2+Ca(OH)2=CaCO3↓+H2O;
故答案为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑;CO2+Ca(OH)2=CaCO3↓+H2O;
(3)碳酸钠直接加热,碳酸氢钠不直接加热,不直接加热的碳酸氢钠能分解而直接加热的碳酸钠不分解更能说明碳酸氢钠不稳定,
故答案为:NaHCO3;
(4)①碳酸氢钠与过量的氢氧化钙溶于反应生成碳酸钙沉淀和氢氧化钠,其反应的离子方程式为:Ca2++OH-+HCO3-═CaCO3↓+H2O;
故答案为:Ca2++OH-+HCO3-═CaCO3↓+H2O;
②碳酸氢钠与氢氧化钙的物质的量之比为2:1时,反应方程式为2NaHCO3+Ca(OH)2=CaCO3↓+Na2CO3+2H2O,则所得溶液中溶质的化学式为Na2CO3;
故答案为:Na2CO3;
(5)碳酸氢钠分解生成二氧化碳和水蒸气,二氧化碳、水蒸气与过氧化钠反应,其反应的方程式为:2Na2O2+2CO2=2Na2CO3+O2、2Na2O2+2H2 O=4NaOH+O2.
故答案为:2Na2O2+2CO2=2Na2CO3+O2、2Na2O2+2H2 O=4NaOH+O2.
点评 本题考查了碳酸钠和碳酸氢钠的性质,注意装置与物质性质的关系,明确碳酸钠和盐酸反应分两步进行为解答的关键,侧重二者与酸的反应及稳定性比较的考查,题目难度不大.

| A. | 20mL 0.3mol/L的硫酸溶液 | B. | 30mL 0.2mol/L的硫酸溶液 | ||
| C. | 20mL 0.2mol/L的硫酸溶液 | D. | 10mL 0.4mol/L的硫酸溶液 |
| A. | 1 mol K2O2中含有的阴、阳离子总数是4NA | |
| B. | 0.2molO3与6.72LO2均含有0.6NA个氧原子 | |
| C. | 常温常压下,22g P4O6与P4O10的混合物中含有氧原子的数目为0.6NA | |
| D. | 10gD216O所含的中子数为5NA |
| A. | 0.062 mol/L | B. | 0.62 mol/L | C. | 6.2mol/L | D. | 62mol/L |
| 弱电解质 | H2CO3 | NH3•H2O |
| 电离平衡常数 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Kb=1.77×10-5 |
①该溶液呈碱性(填“酸”、“中”、“碱”),原因是由于NH3•H2O的电离平衡常数大于HCO3-的电离平衡常数,因此CO32-水解程度大于NH4+水解程度,溶液呈碱性
②该(NH4)2CO3溶液中各微粒浓度之间的关系式不正确的是BE.
A.c(NH4+)>c(CO32-)>c(HCO3-)>c(NH3•H2O)
B.c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C.c(CO32-)+c(HCO3-)+c(H2CO3)=0.1mol/L
D.c(NH4+)+c(NH3•H2O)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
E.c(H+)+c(HCO3-)+c(H2CO3)=c(OH-)+c(NH3•H2O)