题目内容
10.向紫色石蕊试液中加入过量的Na2O2粉末,振荡,正确的是( )| A. | 最后溶液为无色 | B. | 最后溶液为蓝色 | C. | 溶液仍为紫色 | D. | 最后溶液为红色 |
分析 向紫色石蕊试液中加入过量的Na2O2粉末,过氧化钠先与水反应生成氢氧化钠和氧气,成碱性使溶液变为蓝色,后过量的Na2O2粉末又具有强氧化性漂白,据此分析.
解答 解:向紫色石蕊试液中加入过量的Na2O2粉末,过氧化钠先与水反应生成氢氧化钠和氧气,成碱性使溶液变为蓝色,后过量的Na2O2粉末又具有强氧化性漂白,所以看到的现象为溶液先变为蓝色后褪色,并有气泡产生,故只有A正确,故选:A.
点评 本题考查过氧化钠的性质,为高频考点,把握物质的性质及用途、反应与现象的关系、反应原理的应用为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
15.关于测定1mol氢气体积的操作中,错误的是( )
| A. | 先检查装置的气密性 | |
| B. | 镁带用砂纸擦去表面的氧化层后称量 | |
| C. | 反应结束后立即读取气体体积 | |
| D. | 加入过量稀硫酸以确保镁带完全反应 |
1.绿原酸的结构简式如图,下列有关绿原酸的说法不正确的是( )


| A. | 分子式为C16H18O9 | |
| B. | 0.1mol绿原酸最多与0.8 molNaOH反应 | |
| C. | 能发生取代反应和消去反应 | |
| D. | 能使酸性高锰酸钾溶液褪色 |
2.碘酸钾是一种白色结晶粉末,无臭无味,酸性条件下碘酸钾是一种较强的氧化剂,与氢碘酸、二氧化硫等还原性物质作用,被还原为单质碘,在碱性介质中,碘酸钾能被氯气、次氯酸盐等氧化为高碘酸钾.碘酸钾在常温下稳定,加热至560℃开始分解.工业生产碘酸钾的流程如下,在反应器中发生反应的化学方程式为:I2+KClO3+H2O→KH(IO3)2+KCl+Cl2↑(未配平)
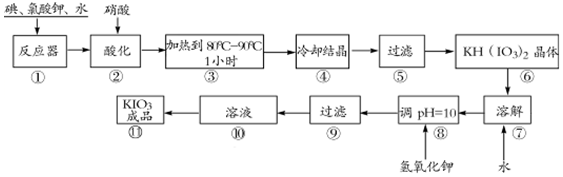
(1)已知步骤①反应器发生的反应中,两种还原产物所得电子数相同,请配平该反应的化学方程式:6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑;
(2)步骤②中,用稀酸酸化的作用是促进氯气从反应混合物中逸出;
(3)步骤③要保持溶液微沸1小时以完全排出氯气,排出氯气的原因为Cl2能将KIO3氧化成KIO4;
(4)参照下表碘酸钾的溶解度,步骤11得到碘酸钾晶体,你建议的方法是蒸发浓缩、冷却结晶.

(1)已知步骤①反应器发生的反应中,两种还原产物所得电子数相同,请配平该反应的化学方程式:6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑;
(2)步骤②中,用稀酸酸化的作用是促进氯气从反应混合物中逸出;
(3)步骤③要保持溶液微沸1小时以完全排出氯气,排出氯气的原因为Cl2能将KIO3氧化成KIO4;
(4)参照下表碘酸钾的溶解度,步骤11得到碘酸钾晶体,你建议的方法是蒸发浓缩、冷却结晶.
| 温度/℃ | 0 | 10 | 20 | 40 | 60 | 80 |
| KIO3g/100g水 | 4.60 | 6.27 | 8.08 | 12.6 | 18.3 | 24.8 |
19.误食NaNO2会导致血红蛋白中的Fe2+氧化为Fe3+而中毒,服用维生素C可以解除NaNO2引起的中毒.下列关于上述中毒、解毒过程的说法中正确的是( )
| A. | NaNO2是还原剂 | |
| B. | 维生素C的还原性强于Fe2+ | |
| C. | 1×10-3molFe2+被NaNO2氧化为Fe3+时得到1×10-3mol电子 | |
| D. | 解毒过程中维生素C被还原 |
20.为减轻温室效应,科学家已致力于研究CO2的捕捉与封存技术,其反应原理之一为:CO2(g)+2NH3(g)?CO(NH2)2(s)+H2O(g)△H<0,下列措施既能加快反应速率又能提高产率的是( )
| A. | 升高温度 | B. | 分离出CO(NH2)2 | C. | 缩小容器体积 | D. | 使用催化剂 |