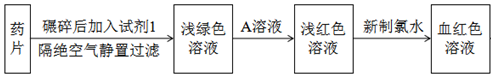
题目内容
18.熔融盐燃料电池具有较高的发电效率,因而受到重视.某燃料电池以熔融的K2CO3(其中不含O2-和)为电解质,以丁烷为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极.试回答下列问题:①该燃料电池正极电极反应式为:O2+CO2+2e-=CO32-.
②25℃时,某学生想用该燃料电池电解一定量的硫酸钠饱和溶液中进行电解,当电路中有a mol电子转移时,溶液中析出mgNa2SO4•10H2O晶体.若温度不变,在剩余溶液中溶质的质量分数为$\frac{71m}{161(m+9a)}$×100%,消耗掉的丁烷在标准状况下的体积为0.86aL.
分析 ①某燃料电池以熔融的K2CO3(其中不含O2-和HCO3-)为电解质,以丁烷为燃料,以空气为氧化剂,则正极电极为氧气发生还原反应生成碳酸根离子;
②电解硫酸钠饱和溶液即电解水,所以当电路中有amol电子转移时,消耗的水的质量为$\frac{a}{2}$g=9ag,结合析出的mgNa2SO4•10H2O晶体,可计算出原饱和溶液的溶质的质量分数,剩余溶液中溶质的质量分数与原饱和溶液的溶质的质量分数相等,根据原池的负极反应C4H10-26e-+13CO32-=17CO2+5H2O可知,当电路中有amol电子转移时,消耗掉的丁烷的物质的量为$\frac{a}{26}$mol,据此答题.
解答 解:①某燃料电池以熔融的K2CO3(其中不含O2-和HCO3-)为电解质,以丁烷为燃料,以空气为氧化剂,则正极电极为氧气发生还原反应生成碳酸根离子,电极反应式为O2+CO2+2e-=CO32-,
故答案为:O2+CO2+2e-=CO32-;
②电解硫酸钠饱和溶液即电解水,所以当电路中有amol电子转移时,消耗的水的质量为$\frac{a}{2}$×18g=9ag,结合析出的mgNa2SO4•10H2O晶体,所以原饱和溶液的溶质的质量分数为$\frac{\frac{142}{322}×m}{9a+m}$×100%=$\frac{71m}{161(m+9a)}$×100%,剩余溶液中溶质的质量分数与原饱和溶液的溶质的质量分数相等,也为 $\frac{71m}{161(m+9a)}$×100%,根据原池的负极反应C4H10-26e-+13CO32-=17CO2+5H2O可知,当电路中有amol电子转移时,消耗掉的丁烷的物质的量为$\frac{a}{26}$mol,其体积为$\frac{a}{26}$mol×22.4L/mol=0.86aL,
故答案为:$\frac{71m}{161(m+9a)}$×100%;0.86aL.
点评 本题考查电化学和化学平衡知识,内容比较综合,在理解所学各部分化学知识的本质区别与内在联系的基础上,本题难度中等,注意守恒思想的运用.

| A. | 道尔顿 | B. | 阿伏加德罗 | C. | 门捷列夫 | D. | 普里斯特利 |
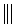 +
+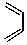 $\stackrel{△}{→}$
$\stackrel{△}{→}$ 如果要合成化合物A,其结构为:
如果要合成化合物A,其结构为: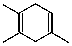 下列说法不正确的是( )
下列说法不正确的是( )| A. | 化合物A和HBr 按照物质的量1:1加成时,有三种不同的产物 | |
| B. | 该反应的原理是加成反应 | |
| C. | 合成A的原料可能是:丙炔和2,3-二甲基-1,3-丁二烯 | |
| D. | 合成A的原料可能是:2-丁炔和2-甲基-1,3-丁二烯 |
①水蒸气液化 ②将胆矾加热变为白色粉末 ③浓硫酸稀释④氯酸钾分解制氧气 ⑤生石灰与水反应生成熟石灰.
| A. | ①④ | B. | ②③ | C. | ①④⑤ | D. | ②④ |
| A. | 最后溶液为无色 | B. | 最后溶液为蓝色 | C. | 溶液仍为紫色 | D. | 最后溶液为红色 |
| A. | 苯、油脂均不能使酸性KMnO4溶液褪色 | |
| B. | 甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应 | |
| C. | 葡萄糖、果糖的分子式均为C6H12O6,二者互为同分异构体 | |
| D. | 除去乙酸乙酯中的乙酸,先加入饱和Na2CO3溶液再分液 |
| A. | 氧化铝刚玉坩埚 | B. | 铁坩埚 | C. | 石英坩埚 | D. | 陶瓷坩埚 |