题目内容
14.下列说法错误的是( )| A. | 如果设“此”为电解质,“彼”为非电解质,不是所有的物质都是非此即彼的 | |
| B. | 不是所有反应,都遵循由强(如强酸、强碱、强氧化剂或强还原剂等)制弱(如弱酸、弱碱、弱氧化剂 或弱还原剂等)的规律 | |
| C. | 不是所有自发进行的反应都一定是焓减少的过程 | |
| D. | 在迄今发现的元素中,不一定所有非金属元素(稀有气体除外)都满足条件“主族元素的族序数≥其周期序数” |
分析 A.单质、混合物等既不是电解质也不是非电解质;
B.硫化氢和硫酸铜就能反应生成硫化铜沉淀和硫酸;
C.△H>0,△S>0,较高温度有利于反应自发进行;
D.非金属性元素的最外层电子数一般≥4,由电子排布规律可知,最外层电子数≥电子层数,(H除外,周期数=最外层电子数).
解答 解:A.因单质、混合物等既不是电解质也不是非电解质,则“此”为电解质,“彼”为非电解质,不是所有的物质都是非此即彼的,故A正确;
B.硫化氢和硫酸铜就能反应生成硫化铜沉淀和硫酸,所以有时弱酸也能制强酸,故B正确;
C.△H>0,△S>0,较高温度有利于反应自发进行,所以焓增大的过程也能自发进行,故C正确;
D.非金属性元素的最外层电子数一般≥4,由电子排布规律可知,最外层电子数≥电子层数,(H除外,周期数=最外层电子数),则一定所有非金属元素(稀有气体除外)都满足条件“主族元素的族序数≥其周期序数”,故D错误;
故选D.
点评 本题为小综合,涉及电解质、非电解质、电子排布、反应自发性等知识,属于高考中的冷拼题,题目难度较大,选项D均为解答中的易错点.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
5.某NaHCO3样品中混有少量的Na2CO3,下列测定该样品纯度的实验方案中不能达到实验目的是( )
| A. | 取样品mg,配成100ml溶液,取25.00mL于锥形瓶中,滴加几滴石蕊试液,用浓度为cmol/L的标准盐酸滴定至终点时,消耗盐酸Vml | |
| B. | 取样品mg,充分加热,冷却,称量固体的质量为n1g | |
| C. | 取样品mg,滴加足量的BaCl2溶液,过滤,洗涤,于燥后称量固体的质量为n2g | |
| D. | 取样品mg,滴加足量的Ba(OH)2过滤,洗涤,干燥后称量固体的质量为n3g |
2.下列说法正确的是( )
| A. | 珍珠、玛瑙、红宝石、水晶的主要成分都是硅酸盐 | |
| B. | 工业上冶炼金属Mg、Cu都采用热还原法 | |
| C. | 氯水、醋酸、小苏打都是电解质 | |
| D. | 利用丁达尔效应可以区别NaCl溶液和Fe(OH)3胶体 |
9.下列物质的制备操作,可以达到实验目的是( )
| A. | 向FeCl3溶液中不断加入NaOH溶液制备Fe(OH)3胶体 | |
| B. | 用铁和Cl2加热制取FeCl3 | |
| C. | 用铜粉和硫粉混合加热制备CuS | |
| D. | 向铝盐溶液中不断滴入烧碱溶液制备Al(OH)3 |
4.下列各組离子在指定的溶液中一定能大量共存的是( )
| A. | 由水电离出的c (OH-)=10-13mol•L-1的溶液中:Na+、Ba2+、Cl-、Br- | |
| B. | c(H+)/c(OH-)=1012的溶液中:Fe2+、Al3+、NO3-、Cl- | |
| C. | 含大量Al3+的溶液中:K+、Na+、SO42-、ClO- | |
| D. | 无色溶液中:K+、Na+、MnO4-、SO42- |
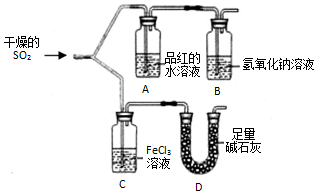 如图装置进行SO2气体性质实验.
如图装置进行SO2气体性质实验.