��Ŀ����
6�������ֿ���������A��B��C��D��E���������������������ӻ�����ͬ���ֱ�������������K+��Fe3+��Cu2+��Ba2+��Al3+������������Cl-��OH-��NO3-��CO32-��X�е�һ�֣���1��ijͬѧͨ���ȽϷ�������Ϊ�������Ϳ��ж����б��е�����������K2CO3��Ba��OH��2��
��2������C�к�������X��Ϊ��ȷ��X���ֽ���1���е��������ʼ�ΪA��B����C��A����Һ���ʱ��������ɫ��������ó����е���ϡHNO3�����������ܽ⣬ʣ���ɫ���壬��XΪB������ţ���
A��Br- B��SO42- C��CH3COO- D��HCO3-
��3����19.2gCuͶ��װ������D��Һ���Թ��У�Cu���ܽ⣬�ٵμ�ϡH2SO4��Cu���ܽ⣬�ܿڸ����к���ɫ������֣�д��Cu�ܽ�����ӷ���ʽ3Cu+8H++2NO3-=3Cu2++2NO��+4H2O��
��Ҫ��Cu��ȫ�ܽ⣬���ټ���H2SO4�����ʵ�����0.4mol��
��4��E��Һ������ᷴӦʱ��������ɫ���ʣ��÷�Ӧ�����ӷ���ʽΪ2Fe3++2I-=2Fe2++I2��
���� CO32-��Fe3+��Cu2+��Ba2+��Al3+���ܴ������棬OH-��Fe3+��Cu2+��Al3+���ܴ������棻����е��������ʼ�ΪA��B��A��B�ֱ�ΪK2CO3��Ba��OH��2��C��A����Һ���ʱ������ɫ��������ó����е�������ϡHNO3�����������ܽ⣬ʣ���ɫ���壬��ɫ����Ϊ������ͭ����ɫ����Ϊ���ᱵ����AӦΪBa��OH��2��C�к�SO42-����CΪCuSO4��DΪAl��NO3��3��EΪFeCl3���ݴ˷�����ɣ�
��� �⣺CO32-��Cu2+��Ba2+��Fe3+��Al3+���ܴ������棬OH-��Fe3+��Al3+��Cu2+���ܴ������棬����е��������ʼ�ΪA��B��A��B�ֱ�ΪK2CO3��Ba��OH��2��C��A����Һ���ʱ������ɫ��������ó����е�������ϡHNO3�����������ܽ⣬ʣ���ɫ���壬��ɫ����Ϊ������ͭ����ɫ����Ϊ���ᱵ����AӦΪBa��OH��2��C�к�SO42-����CΪCuSO4��DΪAl��NO3��3��EΪFeCl3��
��1��������������֪�����е���������Ϊ��K2CO3��Ba��OH��2��
�ʴ�Ϊ��K2CO3��Ba��OH��2��
��2��������������֪��CΪCuSO4����C��XΪSO42-��
�ʴ�Ϊ��B��
��3�����������ƶϿ�֪D�к���NO3-����֪��19.2gCuͶ��װ������D��Һ���Թ��У�Cu���ܽ⣻�ٵμ�ϡH2SO4��Cu���ܽ⣬
�����ķ�ӦΪ3Cu+8H++2NO3-�T3Cu2++2NO��+4H2O
��n��Cu��=$\frac{m}{M}$=$\frac{19.2g}{64g/mol}$=0.3mol��
�з��̿�֪��$\frac{3}{8}$=$\frac{0.3mol}{n��{H}^{+}��}$����ã�n��H+��=0.8mol��
����n��H2SO4��=12n��H+��=0.4mol��
�ʴ�Ϊ��3Cu+8H++2NO3-�T3Cu2++2NO��+4H2O��0.4mol��
��4��EΪFeCl3��E��Һ������ᷴӦʱ��������ɫ���ʣ��÷�Ӧ�����ӷ���ʽΪ��2Fe3++2I-=2Fe2++I2��
�ʴ�Ϊ��2Fe3++2I-=2Fe2++I2��
���� �����ۺ��Խ�ǿ���漰�����ƶϡ����Ӽ��顢���ӷ���ʽ����д��֪ʶ����Ŀ�Ѷ��еȣ���Ҫѧ���������ջ���֪ʶ�������ڿ���ѧ���ķ���������������������

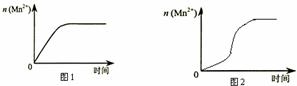 ij��ѧС��Ϊ���о���������Ի�ѧ��Ӧ���ʵ�Ӱ�죬����������ʵ�飺
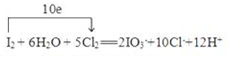
ij��ѧС��Ϊ���о���������Ի�ѧ��Ӧ���ʵ�Ӱ�죬����������ʵ�飺��ʵ��ԭ����2KMnO4+5H2C2O4+3H2SO4�TK2SO4+2MnSO4+10CO2��+8H2O
��ʵ�����ݼ���¼��
| ʵ���� | �����£��Թ��������Լ���������/mL | ��������Һ��ɫ������ɫ����ʱ��/min | |||
| 0.6 mol/L H2C2O4��Һ | H2O | 0.2mol/L KMnO4��Һ | 3 mol/L ϡH2SO4 | ||
| 1 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
| 2 | 3.0 | V1 | 2.0 | 2.0 | 5.2 |
| 3 | 3.0 | 4.0 | V2 | ||
��1�������ϱ��е�ʵ�����ݣ�V1=3.0mL��V2=1.0mL���ɱ������ݿ��Եõ��Ľ����� ����������ͬʱ������KMnO4Ũ�ȷ�Ӧ��������
��2������ʵ�� 1 �����ݼ��㣬�� KMnO4 ��Ũ�ȱ仯��ʾ�ķ�Ӧ����Ϊ v��KMnO4��=1.5��10-2mol/��L•min��
��3����С��ͬѧ���ݾ�������� n��Mn2+����ʱ��仯���Ƶ�ʾ��ͼ����ͼ 1 ��ʾ������ͬѧ��������ʵ���� �Ϸ��֣���ʵ������� n��Mn2+����ʱ��仯����Ӧ��ͼ 2 ��ʾ����С��ͬѧ����ͼ 2 ��ʾ��Ϣ������µļ� �裬����������ʵ��̽��
�ٸ�С��ͬѧ����ļ������������е�MnSO4Ϊ�÷�Ӧ�Ĵ�������Mn2+�Ը÷�Ӧ�д����ã�
�����������С��ͬѧ���ʵ�鷽��������д���пհף�
| ʵ�� ��� | �����£��Թ��������Լ���������/mL | �����Թ��м� ���������� | �� �� ����Һ�� ɫ �� �� �� ɫ �� ��ʱ��/min | |||
| 0.6mol/L H2C2O4 ��Һ | H2O | 0.2mol/L KMnO4 ��Һ | mol/L ϡ ���� | |||
| 4 | 3.0 | 2.0 | 2.0 | t | ||
| A�� | ����衰�ˡ�Ϊ����ʣ����ˡ�Ϊ�ǵ���ʣ��������е����ʶ��ǷǴ˼��˵� | |
| B�� | �������з�Ӧ������ѭ��ǿ����ǿ�ᡢǿ�ǿ��������ǿ��ԭ���ȣ������������ᡢ����������� ������ԭ���ȣ��Ĺ��� | |
| C�� | ���������Է����еķ�Ӧ��һ�����ʼ��ٵĹ��� | |
| D�� | �������ֵ�Ԫ���У���һ�����зǽ���Ԫ�أ�ϡ��������⣩����������������Ԫ�ص��������������������� |
| A�� | ��������ˮ��Cl2+H2O=2H++C1-+C1O- | |
| B�� | ��������Һ�м���������ˮ��Al3++4OH-=AlO2-+2H2O | |
| C�� | FeS04��Һ��ϡ���ᷴӦ��3Fe2++NO3-+4H+=3Fe3++NO+2H2O | |
| D�� | ϡ�����м������ۣ�2Fe+6H+�T2Fe3++3H2�� |
| A�� | HCl | B�� | NH4Cl | C�� | Na2CO3 | D�� | NaCl |
| A�� | Mg3N2�����еĻ�ѧ���ǹ��ۼ� | |
| B�� | ij���ʺ������Ӽ�������������κ������¾��ܵ��� | |
| C�� | �ɱ��Ƿ��Ӿ��壬������������ֻ��˷����Ӽ������� | |
| D�� | ���³�ѹ�£���̬���ʷ����У�ÿ��ԭ�ӵ�����㶼����8�����ȶ��ṹ |
| A�� | 0.1mol/L��������Һ | B�� | 0.1mol/L��CaCl2��Һ | ||
| C�� | 0.2mol/L��NaCl��Һ | D�� | 0.1mol/L������ |
| A�� | ��Ӧ����60sʱ��X��Y��Z��Ũ����� | |
| B�� | ��Ӧ����80sʱ���淴Ӧ���ʴ�������Ӧ���� | |
| C�� | ��XŨ�ȱ仯��ʾ�ķ�Ӧ����Ϊ0.06mol/��L•min�� | |
| D�� | ��Ӧ����80sʱ��Y���ʵ���Ũ��Ϊ0.03mol/L |
 ��
��