题目内容
20.下列电子排布中,原子处于激发状态的是( )| A. | 1s22s22p5 | B. | 1s22s22p43s2 | ||
| C. | 1s22s22p63s23p63d54s1 | D. | 1s22s22p63s23p63d34s2 |
分析 原子的核外电子排布符合基态原子核外电子填充的能级顺序和能量最低原理、泡利不相容原理及洪特规则,原子处于基态,否则为激发态,以此进行判断.
解答 解:A.电子排布式为1s22s22p5符合能量最低原理,所以为基态原子,故A不选;
B.电子排布式为1s22s22p43s2不符合能量最低原理,根据能量最低原理知,其基态应为1s22s22p6,故B选;
C.电子排布式为1s22s22p63s23p63d54s1符合能量最低原理,所以为基态原子,故C不选;
D.电子排布式为1s22s22p63s23p63d34s2符合能量最低原理,所以为基态原子,故D不选;
故选:B.
点评 本题考查原子核外电子的排布,侧重于激发态的判断,可根据能量最低原理进行判断,题目难度不大.

练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案
相关题目
11.卤块的主要成分是MgCl2,此外还含Fe3+、Fe2+和Mn2+等离子.若以它为原料按图所示工艺流程进行生产,可制得轻质氧化镁(已知其中有一种中间产物是MgCO3).

若要求产品尽量不含杂质,而且生产成本较低,根据表1和表2提供的资料,填写空白:
表1生成氢氧化物沉淀的pH
表2原料价格表
已知:Fe2+氢氧化物呈絮状,不易从溶液中除去,常将它氧化为Fe3+,生成Fe(OH)3沉淀除去.
(1)在步骤②中加入的试剂X,最佳的选择是漂液NaClO,其反应的离子方程式是2Fe2++ClO-+2H+═2Fe3++Cl-+H2O.
(2)在步骤③中如要控制pH=9.8,其目的是使除Mg2+以外的各种杂质金属离子都成为氢氧化物沉淀以便除去;在步骤④中加入的试剂Z应该是Na2CO3;
(3)在步骤⑤中发生的化学方程式是MgCO3+H2O $\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2+CO2↑.

若要求产品尽量不含杂质,而且生产成本较低,根据表1和表2提供的资料,填写空白:
表1生成氢氧化物沉淀的pH
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.6 | 11.1 |
| 物质 | 价格/元?吨-1 |
| 漂液(含25.2%NaClO) | 450 |
| 双氧水(含30%H2O2) | 2400 |
(1)在步骤②中加入的试剂X,最佳的选择是漂液NaClO,其反应的离子方程式是2Fe2++ClO-+2H+═2Fe3++Cl-+H2O.
(2)在步骤③中如要控制pH=9.8,其目的是使除Mg2+以外的各种杂质金属离子都成为氢氧化物沉淀以便除去;在步骤④中加入的试剂Z应该是Na2CO3;
(3)在步骤⑤中发生的化学方程式是MgCO3+H2O $\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2+CO2↑.
8.颠茄酸酯(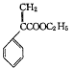 )是一种用于胃肠道平滑肌痉挛及溃疡病的辅助治疗药物,下列说法正确的是( )
)是一种用于胃肠道平滑肌痉挛及溃疡病的辅助治疗药物,下列说法正确的是( )
 )是一种用于胃肠道平滑肌痉挛及溃疡病的辅助治疗药物,下列说法正确的是( )
)是一种用于胃肠道平滑肌痉挛及溃疡病的辅助治疗药物,下列说法正确的是( )| A. | 不能使酸性KMnO4溶液褪色 | |
| B. | 1mol颠茄酸酯最多与4molBr2发生加成反应 | |
| C. | 能与NaHCO3溶液反应 | |
| D. | 能与NaOH溶液反应 |
12.在0.1mol/L NaHSO3溶液中存在着微粒浓度的关系式,正确的是( )
| A. | c(Na+)>c(HSO3-)>c(SO32-)>c(H+)>c(OH-) | B. | c(Na+)+c(H+)=c(HSO3-)+c(SO32-)+c(OH-) | ||
| C. | c(H2SO3)+c(H+)=c(SO32-)+c(OH-) | D. | c(Na+)=c(HSO3-)+2c(SO32-)+c(H2SO3) |
9.将0.01mol NaOH和0.01mol Na2CO3混合并配成溶液,滴加amL、0.1mol•L-1稀盐酸,下列说法不正确的是( )
| A. | 当a≤100时,发生的离子反应为:OH-+H+=H2O | |
| B. | 当a≥300时,发生的离子反应为:OH-+3H++CO32-=2H2O+CO2↑ | |
| C. | 当100<a<200时,反应后的溶液中CO32-与HCO3-的物质的量之比为(a×10-4-0.01):(0.02-a×10-4) | |
| D. | 当a=200时,发生的离子反应为:OH-+2H++CO32-=H2O+HCO3- |
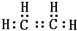 B的结构简式CH3CH2OH
B的结构简式CH3CH2OH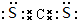 .
.
 W、X、Y、Z、M、Q均为稀有气体外的短周期元素,其原子序数依次增大,X的最外层电子数是W的电子总数的4倍,Z与M最外层电子数相同,X与M在周期表中的位置如图:
W、X、Y、Z、M、Q均为稀有气体外的短周期元素,其原子序数依次增大,X的最外层电子数是W的电子总数的4倍,Z与M最外层电子数相同,X与M在周期表中的位置如图: .
.