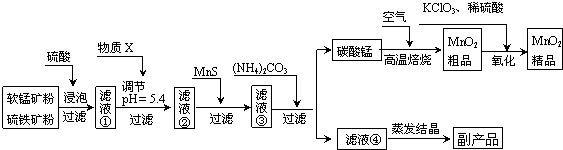
题目内容
设NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、78g Na2O2晶体中离子总数为4NA |
| B、常温下,2L、1 mol?L-1的乙酸溶液中,所含分子总数小于2NA |
| C、标准状况下,5.6L NO和5.6 L O2组成的混合气体中所含原子数为NA |
| D、对于反应:C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l)△H=-1300 kJ/mol,有2NA个碳氧双键形成时,放出1300 kJ的热量 |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.过氧化钠中阴离子为过氧根离子,78g过氧化钠的物质的量为1mol,含有2mol钠离子、1mol过氧根离子;
B.乙酸溶液中含有乙酸分子和水分子,忽略了水分子;
C.根据质量守恒定律计算出混合气体中含有的原子数;
D.二氧化碳分子中含有2个碳氧双键,放出1300kJ热量时生成2mol二氧化碳,形成4mol碳氧双键.
B.乙酸溶液中含有乙酸分子和水分子,忽略了水分子;
C.根据质量守恒定律计算出混合气体中含有的原子数;
D.二氧化碳分子中含有2个碳氧双键,放出1300kJ热量时生成2mol二氧化碳,形成4mol碳氧双键.
解答:
解:A.78g过氧化钠的物质的量为1mol,1mol过氧化钠中含有2mol钠离子、1mol过氧根离子,总共含有3mol离子,离子总数为3NA,故A错误;
B.2L 1 mol?L-1的乙酸溶液中含有2mol乙酸,由于乙酸在溶液中电离程度减小,溶液中还含有水分子,则该乙酸溶液中含有的分子的物质的量大于2mol,所含分子总数大于2NA,故B错误;
C.标准状况下,5.6L NO的物质的量为0.25mol,含有0.5mol原子;标况下5.6 L O2的物质的量为0.25mol,含有0.5mol原子,根据质量守恒可知,混合气体中含有1mol原子,混合气体中所含原子数为NA,故C正确;
D.反应C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l)△H=-1300 kJ/mol中,有2NA个碳氧双键形成时生成了1mol二氧化碳,放出
1300 kJ=650kJ的热量,故D错误;
故选C.
B.2L 1 mol?L-1的乙酸溶液中含有2mol乙酸,由于乙酸在溶液中电离程度减小,溶液中还含有水分子,则该乙酸溶液中含有的分子的物质的量大于2mol,所含分子总数大于2NA,故B错误;
C.标准状况下,5.6L NO的物质的量为0.25mol,含有0.5mol原子;标况下5.6 L O2的物质的量为0.25mol,含有0.5mol原子,根据质量守恒可知,混合气体中含有1mol原子,混合气体中所含原子数为NA,故C正确;
D.反应C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l)△H=-1300 kJ/mol中,有2NA个碳氧双键形成时生成了1mol二氧化碳,放出
| 1 |
| 2 |
故选C.
点评:本题考查阿伏加德罗常数的应用,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系,选项B为易错点,注意乙酸溶液中含有乙酸分子和水分子.

练习册系列答案
相关题目
下列叙述不正确的是( )
A、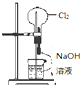 . .挤压胶头滴管后会看到烧瓶中形成喷泉 |
B、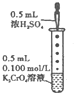 滴加几滴浓H2SO4后,溶液颜色由黄色变为橙色 |
C、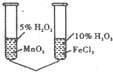 由该实验可以验证催化剂的催化效果 |
D、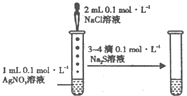 能验证AgCl沉淀可转化为溶解度更小的Ag2S沉淀 |
下列实验操作、实验现象及解释与结论正确的是( )
| A、向某溶液中同时滴入几滴KSCN溶液和少量新制氯水 溶液变为红色 原溶液一定含有Fe2+ |
| B、向AgCl的饱和溶液中加入少量NaCl晶体 无明显现象 NaCl溶于水,阻止了AgCl的溶解 |
| C、相同温度下,测定等物质的量浓度的Na2CO3和Na2SiO3两溶液的pH 后者的pH大 碳的非金属性比硅强 |
| D、在溴水中加入少量某有机物,充分振荡、静置 溴水褪色 该有机物中含有碳碳双键 |
已知二甲苯苯环上的一溴代物有6种同分异构体,则四甲苯苯环上的溴代物有( )
| A、3种 | B、6种 | C、2种 | D、4种 |