题目内容
如图是一些常见的单质、化合物之间的转化关系图,有些反应中的部分物质被略去.常温常压下,A为无色有毒气体,B为红棕色粉末,C、E为金属单质.反应①②均为工业上的重要反应.
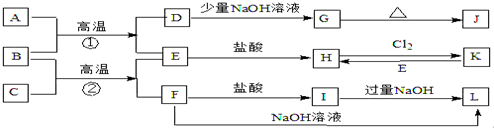
请回答下列问题:
(1)写出下列物质的化学式:B D H G
(2)检验物质K所用的试剂和现象是 .
(3)写出B与C高温反应生成E和F的化学方程式: .
(4)写出I生成L的离子方程式: .

请回答下列问题:
(1)写出下列物质的化学式:B
(2)检验物质K所用的试剂和现象是
(3)写出B与C高温反应生成E和F的化学方程式:
(4)写出I生成L的离子方程式:
考点:无机物的推断
专题:
分析:B为红棕色粉末,应为Fe2O3,A为无色有毒气体,结合转化关系,可推知A具有还原性,故A为CO,则D为CO2,E为Fe;顺推可知G为NaHCO3,J为Na2CO3,H是FeCl2,K为FeCl3,金属C与氧化铁反应生成Fe与F,F为金属氧化物,既与盐酸反应又能与氢氧化钠反应,F应为Al2O3,则C是Al,I为AlCl3,L为NaAlO2,结合物质的性质解答该题.
解答:
解:B为红棕色粉末,应为Fe2O3,A为无色有毒气体,结合转化关系,可推知A具有还原性,故A为CO,则D为CO2,E为Fe;顺推可知G为NaHCO3,J为Na2CO3,H是FeCl2,K为FeCl3,金属C与氧化铁反应生成Fe与F,F为金属氧化物,既与盐酸反应又能与氢氧化钠反应,F应为Al2O3,则C是Al,I为AlCl3,L为NaAlO2,
(1)由以上分析可知B为Fe2O3,D为CO2,H为FeCl2,G为NaHCO3,故答案为:Fe2O3;CO2;FeCl2;NaHCO3;
(2)K为FeCl3,检验Fe3+可用KSCN溶液,溶液变红色,故答案为:KSCN溶液、溶液变红色;
(3)B与C高温反应生成E和F的反应是铝和氧化铁发生的铝热反应,化学方程式为Fe2O3+2Al
A12O3+2Fe,故答案为:Fe2O3+2Al
A12O3+2Fe;
(4)I生成L的离子方程式Al3++4OH-=AlO2-+2H2O,故答案为:Al3++4OH-=AlO2-+2H2O.
(1)由以上分析可知B为Fe2O3,D为CO2,H为FeCl2,G为NaHCO3,故答案为:Fe2O3;CO2;FeCl2;NaHCO3;
(2)K为FeCl3,检验Fe3+可用KSCN溶液,溶液变红色,故答案为:KSCN溶液、溶液变红色;
(3)B与C高温反应生成E和F的反应是铝和氧化铁发生的铝热反应,化学方程式为Fe2O3+2Al
| ||
| ||
(4)I生成L的离子方程式Al3++4OH-=AlO2-+2H2O,故答案为:Al3++4OH-=AlO2-+2H2O.
点评:本题考查无机物的推断,题目难度中等,本题注意以A、B为该题的突破口进行推断,注意把握相关物质的性质,为该题考查的侧重点,学习中注意把握.

练习册系列答案
相关题目
将十水碳酸钠与碳酸氢钠的混合物4.54g溶于水,配成100ml溶液.测得溶液中钠离子的物质的量浓度为0.4mol/L,在溶液中加入过量的盐酸,完全反应后,将溶液蒸干灼烧至质量不变,则所得固体的质量为( )
| A、4.54g |
| B、3.34g |
| C、2.57g |
| D、2.34g |
验证某有机物属于烃的含氧衍生物,应完成的实验内容是( )
| A、只要验证它完全燃烧后产物只有H2O和CO2 |
| B、只要测定其燃烧产物中H2O和CO2物质的量的比值 |
| C、测定该试样的质量及其试样完全燃烧后生成H2O和CO2的质量 |
| D、测定完全燃烧时消耗有机物与生成H2O和CO2的物质的量之比 |
下列说法正确的是( )
| A、少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗 |
| B、将含硫酸的废液倒入水槽,用水冲入下水道 |
| C、用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部加热蒸干 |
| D、蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶支管口处 |
下列说法正确的是( )
| A、1 mol葡萄糖能水解生成2 mol CH3CH2OH和2 mol CO2 |
| B、在鸡蛋清溶液中分别加入饱和Na2SO4、CuSO4溶液,都会因盐析产生沉淀 |
| C、油脂不是高分子化合物,1 mol油脂完全水解生成1 mol甘油和3 mol高级脂肪酸 |
| D、欲检验蔗糖水解产物是否具有还原性,可向水解后的溶液中直接加入新制的Cu(OH)2悬浊液并加热 |
已知常温下,浓度均为0.1mol?L-1的4种钠盐溶液pH如下表:下列说法中正确的是( )
| 溶质 | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
| pH | 11.6 | 9.7 | 10.3 | 5.2 |
| A、足量SO2通入NaClO溶液中发生反应的离子方程式为:H2O+SO2+ClO-=HClO+HSO3- |
| B、向氯水中加入NaHCO3,可以增大氯水中次氯酸的浓度 |
| C、常温下,相同物质的量浓度的H2SO3、H2CO3、HClO溶液,pH最大的是H2SO3 |
| D、NaHSO3溶液中离子浓度大小顺序为:c(Na+)>c(H+)>c(HSO3-)>c(SO32-)>c(OH-) |
下列离子的VSEPR模型与离子的空间立体构型一致的是( )
| A、SO32- |
| B、ClO4- |
| C、NO2- |
| D、ClO3- |
下列有关新闻事件的叙述正确的是( )
| A、在结冰的路面上撒盐,是利用盐与水发生化学反应放出大量热量,促使冰雪融化 |
| B、我国决定推广使用车用乙醇汽油,乙醇汽油是一种新型的化合物,属于可再生能源 |
| C、利用可降解的生物质材料“玉米塑料”(主要成分为聚乳酸)替代一次性饭盒,可防止产生白色污染 |
| D、氮化硅陶瓷可用于制造新型柴油发动机是因为氮化硅陶瓷具有较大的硬度 |
原子序数依次增大的X、Y、Z、W四种短周期元素,X、W原子的最外层电子数与其电子层数相等,X、Z的最外层电子数之和与Y、W的最外层电子数之和相等.甲的化学式为YX3,是一种刺激性气味的气体,乙的化学式为YZ3,丙是由X、Y、Z组成的盐.下列说法正确的是( )
| A、原子半径:W>Y>Z,而离子半径:Z>Y>W |
| B、甲沸点远高于乙,可能是甲分子间存在氢键所致 |
| C、测得丙的水溶液呈酸性,则溶液中丙盐阳离子浓度大于酸根离子浓度 |
| D、W的氯化物水溶液中通入YX3至过量,现象是先有白色沉淀,后逐渐溶解 |