题目内容
2.A、B、C、D是四中短周期元素,原子序数依次增大,且只有C为金属元素,A、C位于同一主族,B的最外层电子数为次外层的3倍,B、C的最外层电子数之和与D的最外层电子数相等,请回答下列问题:(1)D元素在元素周期表中的位置第三周期ⅦA族,写出实验室制取D单质的化学方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)A、B、C形成的化合物所含化学键类型共价键;离子键.
(3)用电子式表示C、D构成化合物形成过程
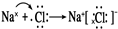
(4)由元素B和D形成的单质或化合物能用于自来水消毒的是O3、Cl2、ClO2.
分析 短周期元素A、B、C、D原子序数依次增大,B的最外层电子数是次外层的3倍,最外层电子数不超过8个,则次外层为K层,则B为O元素;B、C的最外层电子数之和与D的最外层电子数相等,B的最外层电子数为6,D为短周期元素,如果D是Cl元素,则C是Na元素,A、C是同一主族,则A是H元素;如果D是Ar元素,则C是Mg原子,A、C是同一主族,A为Be元素,不符合只有C是金属元素条件,故舍去;所以A、B、C、D分别是H、O、Na、Cl元素,由此分析解答.
解答 解:短周期元素A、B、C、D原子序数依次增大,B的最外层电子数是次外层的3倍,最外层电子数不超过8个,则次外层为K层,则B为O元素;B、C的最外层电子数之和与D的最外层电子数相等,B的最外层电子数为6,D为短周期元素,如果D是Cl元素,则C是Na元素,A、C是同一主族,则A是H元素;如果D是Ar元素,则C是Mg原子,A、C是同一主族,A为Be元素,不符合只有C是金属元素条件,故舍去;所以A、B、C、D分别是H、O、Na、Cl元素,
(1)D为Cl元素,在周期表中处于第三周期ⅦA族,实验室制取氯气的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:第三周期ⅦA族;MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)A、B、C形成的化合物是氢氧化钠所含化学键类型是共价键;离子键,故答案为:共价键;离子键;
(3)钠与氯形成离子化合物,形成过程表示为: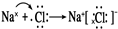 ,故答案为:
,故答案为: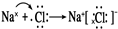 ;
;
(4)由元素B和D形成的单质或化合物能用于自来水消毒的是O3、Cl2、ClO2等,故答案为:O3、Cl2、ClO2中的两种.
点评 本题考查结构性质与位置关系,推断元素是解题关键,以B元素为突破口,综合分析原子序数、最外层电子数关系进行推断,侧重对化学用语的考查,难度中等.

 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案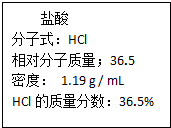 (I)表中①~⑥均是由Na、Mg、H、O、S、Cl等元素中的几种组成,根据物质的组成和性质将它们进行了分类.
(I)表中①~⑥均是由Na、Mg、H、O、S、Cl等元素中的几种组成,根据物质的组成和性质将它们进行了分类.| 物质类别 | 含氧强酸 | 碱 | 钠盐 |
| 化学式 | ①H2SO4②HClO4 | ③ ④Mg(OH)2 ④Mg(OH)2 | ⑤NaCl ⑥Na2SO3 |
 .
.(2)①的稀溶液和⑥的溶液反应的离子方程式为:2H++SO32-═H2O+SO2↑.
(II)如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
(1)该浓盐酸中HCl的物质的量浓度为:11.9mol/L.
(2)某学生欲用上述浓盐酸和蒸馏水配置500mL 物质的量浓度为0.400mol/L的稀盐酸.
①该学生需要量取16.8mL上述浓盐酸.
②实验中除合适的量筒、烧杯、玻璃棒外还需要的玻璃仪器有500mL容量瓶、胶头滴管.
③在配置过程中,下列实验操作对所配稀盐酸的物质的量浓度有何影响?(填“偏高”、“偏低”或无影响).
a.用量筒量取浓盐酸时俯视读数偏低.
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量蒸馏水偏低.
(3)①假设该同学成功配置了0.400mol/L的盐酸,他又用该盐酸中和含0.4g NaOH的氢氧
化钠溶液,该同学需取25mL盐酸.
②该同学用新配置的盐酸中和含0.4g NaOH的氢氧化钠溶液,发现实际所用体积偏小,则可能
的原因是C.
A.盐酸挥发,浓度不足 B.配置过程中未洗涤烧杯和玻璃棒
C.配置溶液定容时,俯视容量瓶刻度线 D.加水超过刻度线,用胶头滴管吸出.
| A. | 分馏 | B. | 干馏 | C. | 裂化 | D. | 裂解 |
(1)一定条件下,9.80g NH4Br跟3.60g的某钙盐A恰好反应,生成了4.48L(标准状况)气态产物B和固体产物C.标准状况下,B气体的密度为0.76g/L,氮的质量分数为82.35%,其余是氢.求B的分子式
(2)25℃、101.3KPa时,气体摩尔体积为24.5L/mol.该状况下,1体积水(密度为1g/cm3)吸收560体积B气体得到密度为0.91g/cm3的溶液,则该溶液中溶质的质量分数为27.99%(溶液中的溶质以B计量;保留2位小数);溶液的物质的量浓度为14.98 mol/L(保留2位小数).
(3)在催化剂作用下,B可和NO、NO2混合气体反应生成液态水和一种单质气体D(可不考虑气体反应物与生成的液态水之间的作用).在常温常压下,将密度一定的NO、NO2混合气体和B在不同体积比时进行了四次实验,所得数据如下:
| 实验次数 | B与混合气体的体积比 | 反应后气体密度(已换算为标准状况;g/L) |
| 第一次 | 1.0 | 1.35 |
| 第二次 | 1.2 | 1.25 |
| 第三次 | 2.0 | 1.04 |
| 第四次 | 2.2 | -- |
(4)将9.80g NH4Br跟过量的氧化鈣共热,充分反应后生成水、1.70gB气体和固体产物C,则C的化学式为CaN2H4;试根据有关数据,求钙盐A的化学式:
| A. | 用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+═Cu2++2Fe2+ | |
| B. | Na2O2与H2O反应制备O2:Na2O2+H2O═2Na++2OH-+O2↑ | |
| C. | 将氯气溶于水制备次氯酸:Cl2+H2O═2H++Cl-+ClO- | |
| D. | 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O |
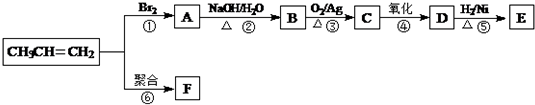
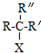 $\stackrel{NaOH/H_{2}O}{→}$
$\stackrel{NaOH/H_{2}O}{→}$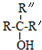 (X为卤素原子,R,R′,R″均为烃基或H原子)
(X为卤素原子,R,R′,R″均为烃基或H原子)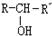 $\stackrel{O_{2}/Ag}{→}$
$\stackrel{O_{2}/Ag}{→}$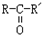 ,
,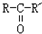 $\stackrel{H_{2}/Ni}{→}$
$\stackrel{H_{2}/Ni}{→}$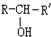
 ; D的结构简式是O=C(CH3)COOH.
; D的结构简式是O=C(CH3)COOH. .
.