题目内容
9.设NA表示阿伏加德罗常数的值,下列叙述正确的是( )| A. | 标准状况下,78g Na2O2的分子数为NA | |
| B. | 标准状况下,22.4L氯气在任何反应中转移电子数均为2NA | |
| C. | 标准状况下,22.4mL H2O中含水分子的个数约为1.24NA | |
| D. | 17g NH3溶于水后溶质NH3的个数为NA |
分析 A.过氧化钠为离子化合物;
B.氯气参加反应后氯元素的价态可能为-1价或+1价或+3价或+5价或+7价,据此分析;
C.标况下水的密度为1g/ml,据此计算水的物质的量及分子个数;
D.氨气溶于水,部分与水反应生成一水合氨,一水合氨部分电离生成铵根离子;
解答 解:A.过氧化钠为离子化合物,不存在分子,故A错误;
B.标准状况下,22.4L氯气物质的量为$\frac{22.4L}{22.4L/mol}$=1mol,反应后氯元素的价态可能为-1价或+1价或+3价或+5价或+7价,故转移的电子数无法确定,故B错误;
C.标准状况下,22.4mL H2O物质的量为$\frac{22.4g}{18g/mol}$≈1.24mol,含水分子的个数约为1.24NA,故C正确;
D.氨气溶于水,部分与水反应生成一水合氨,一水合氨部分电离生成铵根离子,所以17g NH3溶于水后溶质NH3的个数小于NA,故D错误;
故选:C.
点评 本题考查物质的量的有关计算,明确过氧化钠结构、熟练掌握公式的使用和物质的结构是解题关键,注意氨水的成分,题目难度不大.

练习册系列答案
相关题目
19.常温下PH=2的一元酸HA与PH=12的KOH溶液等体积混合,所得溶液显酸性.现将amol/LHA bmol/LKOH等体积混合,下列有关的推断正确的是( )
| A. | 若a>b,一定存在c(A-)=c(K+) | B. | 若a=2b,一定存在c(A-)>c(K+) | ||
| C. | 若2a=b,一定存在c(OH-)>c(A-) | D. | 若a=b,一定存在c(OH-)=c(H+)+c(HA) |
1.能形成XY2共价化合物的元素X和Y,其原子最外层电子排布是( )
| A. | 3s2和3s23p5 | B. | 2s22p2和2s22p4 | C. | 1s1和3s23p4 | D. | 3s23p4和2s22p4 |
13.同周期的X、Y、Z三种元素,已知它们的最高价氧化物对应的水化物是HXO4、H2YO4、H3ZO4,则下列判断正确的是( )
| A. | 含氧酸的酸性:H3ZO4>H2YO4>HXO4 | |
| B. | 原子半径:Z>Y>X | |
| C. | 气态氢化物的稳定性按X、Y、Z顺序由弱到强 | |
| D. | 元素的负化合价的绝对值按X、Y、Z顺序由小到大 |
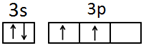 .
.