题目内容
10.NA为阿伏加德罗常数,下列说法中正确的是( )| A. | 将2mL 0.5mol•L-1Na2SiO3溶液滴入稀盐酸中制得H2SiO3胶体,所含胶粒数为0.001NA | |
| B. | 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA | |
| C. | 标准状况下,20g D2O分子中所含中子数为10NA | |
| D. | 将1mol Cl2通入水中,HClO、Cl-、ClO-粒子数之和为2NA |
分析 A.H2SiO3胶粒是多个H2SiO3的聚集体;
B.气体所处的状态不明确;
C.重水的摩尔质量为20g/mol,且重水中含10个中子;
D.氯气溶于水,部分与水反应生成氯化氢和次氯酸,部分以氯气分子形式存在.
解答 解:A.H2SiO3胶粒是多个H2SiO3的聚集体,故将2mL0.5 mol•L-1Na2SiO3溶液滴入稀盐酸中制得H2SiO3胶体,所含胶粒数小于0.001NA,故A错误;
B.气体所处的状态不明确,不一定为标况下,故其物质的量无法计算,故转移的电子数无法计算,故B错误;
C.重水的摩尔质量为20g/mol,故20g重水的物质的量为1mol,而且重水中含10个中子,故1mol重水中含10mol中子即10NA个,故C正确;
D.氯气溶于水,部分与水反应生成氯化氢和次氯酸,部分以氯气分子形式存在,所以将lmol Cl2通入水中,HClO、Cl-、ClO- 粒子数之和小于2NA,故D错误;
故选:C.
点评 本题考查了有关阿伏伽德罗常数的应用,注意掌握标况下的气体摩尔体积的使用条件,熟练掌握物质的量与阿伏伽德罗常数、摩尔质量、物质的量浓度之间的关系,题目难度不大.

练习册系列答案
相关题目
11.下列物质属于非电解质的是( )
| A. | 液氯 | B. | 淀粉 | C. | 硝酸钾 | D. | 液态氯化氢 |
18.判断下列有关化学基本概念或名词的依据正确的是( )
| A. | 共价化合物:是否含有共价键 | |
| B. | 纯净物与混合物:是否仅含有一种元素 | |
| C. | 电解质与非电解质:物质本身是否具有导电性 | |
| D. | 溶液与胶体:本质在于分散质粒子直径的大小 |
5.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 常温常压下,28gCO和C2H4混合气体中的碳原子数为NA | |
| B. | 1molN2与3molH2充分反应,产物的分子数为2NA | |
| C. | 标准状况下,11.2L己烷中含有的碳碳键数为2.5NA | |
| D. | 32g硫粉与足量的Cu粉完全反应,转移的电子数为2NA |
15.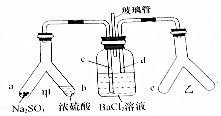 Y形管是一种特殊的仪器,与其他仪器组合可以进行某些实验探究.利用如图装置可以探究SO2与BaCl2反应生成BaSO3沉淀的条件,下列判断正确的( )
Y形管是一种特殊的仪器,与其他仪器组合可以进行某些实验探究.利用如图装置可以探究SO2与BaCl2反应生成BaSO3沉淀的条件,下列判断正确的( )
 Y形管是一种特殊的仪器,与其他仪器组合可以进行某些实验探究.利用如图装置可以探究SO2与BaCl2反应生成BaSO3沉淀的条件,下列判断正确的( )
Y形管是一种特殊的仪器,与其他仪器组合可以进行某些实验探究.利用如图装置可以探究SO2与BaCl2反应生成BaSO3沉淀的条件,下列判断正确的( )| A. | 玻璃管的作用是连通大气,使空气中的氧气进人广口瓶,参与反应 | |
| B. | c、d两根导管郡必须插人BaCl2溶液中,保证气体与Ba2+充分接触 | |
| C. | Y形管乙中产生的为氧化性气体,将BaSO3氧化为BaSO4沉淀 | |
| D. | e、f两管中的试剂可以分别是浓氨水和NaOH |
2.检验乙烯中的二氧化硫气体,下列试剂不能达到目的是( )
| A. | 品红溶液 | B. | 澄清石灰水 | C. | 酸性KMnO4溶液 | D. | 石蕊溶液 |
19.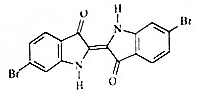 地中海沿岸出产的一种贵重染料经化学分析,其主要组成的结构如图所示,下列说法不正确的是( )
地中海沿岸出产的一种贵重染料经化学分析,其主要组成的结构如图所示,下列说法不正确的是( )
 地中海沿岸出产的一种贵重染料经化学分析,其主要组成的结构如图所示,下列说法不正确的是( )
地中海沿岸出产的一种贵重染料经化学分析,其主要组成的结构如图所示,下列说法不正确的是( )| A. | 属于烃的衍生物 | |
| B. | 分子式为C16H8O2N2Br2 | |
| C. | 1mol该有机物与H2加成最多消耗9molH2 | |
| D. | 该有机物溴元素检验可将有机物与碱液共热后,直接加入硝酸银溶液,观察是否有浅黄色沉淀生成. |
20.下列物质用加热的方法可分离的是( )
| A. | 氯化铵和消石灰固体 | B. | 碳酸氢铵和过氧化钠固体 | ||
| C. | 碘化钾和碘晶体 | D. | 硝酸钾与食盐晶体 |